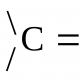Molekularni raspon. Kofuzijski spektri dvoatomnih molekula Kemija kofuzijskih spektara elementa
tipi kolivani
Energija potrebna za uništavanje cijepanja atoma u molekuli, utječući na energiju svjetlosnih kvanta s dugim perom od 1-15 mikrona, ili s brojem pera od 400 ÷ 4000 cm -1, zatim elektromagnetske vibracije srednje infracrvene regija. Sudar je jednak molekulama kvantizacije, energija prijelaza između njih i, također, frekvencije kolavacije mogu biti od manjeg značaja. Kako kvant svjetla blijedi, molekula može ići preko višeg prstena dimnjaka, zvučeći iz glavnog kolyvalny kampa zbudzheniya. Energija gline se zatim prenosi na revitalizaciju vanjskih slojeva ili se pretvara u kinetičku energiju molekula. Spajanje molekula promatra se u dvije vrste spektra: spektri blještanja u infracrvenom području (IC-spektri) i spektri kombinatorne difuzije svjetlosti (Raman spektri).
Matematički model fuzije bogatih atomskih molekula je sklopiv. Analiza je provedena samo za najjednostavnije dvoatomne molekule. Kolivalna spektroskopija može imati prenaglašeni empirijski karakter, tobto. glavne frekvencije koliviranja oduzimaju se iz izvedbe spektra bogatih spojeva iste klase. Tse, međutim, ne primjenjuje vrijednost metode.
Glavne vrste kolivinga su valencija i deformacija.
Voljeni kolivacija se naziva kolivanija jezgri atoma u zračnim vodovima veze, smrad se označava slovom n (nC=C, nC=O i tako dalje.).
Približan mehanički model valentnih kolivana može biti sustav dviju zavojnica povezanih tvrdom oprugom (ovdje zavojnice predstavljaju atome, a opruga je kemijska veza) (div. sl., a).
A, B - valentna kohezija u molekulama;
C - deformacija colivanna: I, II - škare; III, IV - njihala; V - vialoví; VI - torzijski.
Kada se rastegnu aboly, pritisak opruge, hladnjaka, počinje se kolebati oko položaja jednake, tako da će doći do skladne koli, koja se opisuje jednakom.

de n - Učestalost kolika; F - snaga je brza, koja karakterizira minuskulu veze, odnosno snagu koja okreće kuli u položaju ravna; m r - postavlja se masa kul (atoma) koji se izračunavaju za formule

Frekvencije valentnog zvonjenja određene su masom atoma i energijom (energijom) veze. Chim masa više, tim manje učestalost, na primjer:
n C-C" 1000 cm-1; n C-H» 3000 cm -1
Chim zv'yazok mítsníshiy, tim vshe učestalost kolivana, na primjer:
Moguća je pojava prizvuka - kolivana, čija je frekvencija veća u cijelom broju puta, niža u glavnim ( 2n, 3n i tako dalje.). Ozvučite malo slabiji intenzitet prizvuka: za prvi prizvuk postavite ga na 1-10% od intenziteta glavnog tona; Treći prizvuk će zvučati bez ulaska u njega.
Sustav od tri ili više atoma može imati dvije vrste valentnog kolaviranja - sinfazno (u jednoj fazi, ili simetrično, n s ) i antifaza (u različitim fazama, ili antisimetrična, kao ) (Sl. Y), iako termini često stagniraju u simetričnim molekulama. Učestalost antifazne kolivanije je veća, manja od infazne.
Deformacija kolyvannya pov'yazaní íz zminoy valentnost kut, zvízki zvíyazki zagalny atom; smrdi se označavaju slovom d . Pogledajte neke deformacijske pukotine prikazane na slici Z. Za oštećenje deformacijskih pukotina potrebno je manje energije, niže za različite valentne pukotine, a kasnije smrad može imati nižu frekvenciju.
S povećanjem broja atoma u molekuli, broj mogućih kolivana brzo raste. U pravoj molekuli, atomi su blisko povezani jedni s drugima i međusobno djeluju. Spektri molekula su sklopivi skup različitih koliforma, koji se pojavljuju na koži u uskom frekvencijskom intervalu.
Intenzitet glinjenja se, kao iu UV spektroskopiji, određuje molarnim koeficijentom glinenja, ali je u ovom slučaju točnost manja. Ozvučite intenzitet smoga jer se ispostavilo da je glina (A) ili prijenos (T) svjetlosnog toka u postocima. Smugi je također ocijenjen za intenzitet kao jak ( S.), sredina ( od.) i slab ( sl.).
Otrimanya ÍCh spektri
Osnova odabira ÍH spektra leži direktno na glinenim vibracijama za sat prolaska kroz loptu govora. Iz velikog raspona ÍH vikarioznosti, ozvučite srednju regiju vikorista (400-4000 cm -1). U području blizu IC (4000÷14300 cm -1), prizvuci su važniji, da bi se izvršila drugačija analiza. Na daljinu, IF-područje (100÷400 cm -1) vjerojatnije će ispuštati zvukove ugljena i metala.
Shema IF spektrometra slična je shemi UV spektrometra, ali je sustav pribora sklopiviji. ÍCh viprominyuvannya ê toplinski; koristite keramičku frizuru koja služi kao džerel, koji se pali da prođe električnim mlazom. Uz pomoć sustava zrcala, svjetlosni tok je podijeljen u dvije identične izmjene, od kojih je jedna propuštena kroz kivetu s govorom, a druga - kroz kivetu s vodom. Prošla je kroz kivete vibracije da bi ušla u monokromator, koji se sastoji od prizmi, zrcala i proreza, koji se obavijaju okolo, što vam omogućuje da vidite vibraciju sa strogo dodijeljenom frekvencijom i glatko mijenjate frekvenciju. Vrakhovuchi, da u regiji ÍCh ima više neprozirnih govora, prizme su izrađene od monokristala soli. Prilozi visoke klase trebaju imati tri prizme: LiF(2000÷3800 cm -1), NaCl(700÷2000 cm -1) to KVR(400÷700 cm -1). Koža s prizmi u drugom intervalu xvili brojeva daje znatno manju dozu. U brojnim uređajima, disperzija vibracije se razvija uz pomoć difrakcijskih filtara. Intenzitet dvaju svjetlosnih tokova (glavni je isti) koji su prošli kroz monokromator, jedan od njih se automatski prikazuje. Električni signal, koji se uspostavlja kada rezultirajući protok svjetlosti pogodi detektor tipa termopara, pojačava se i bilježi potenciometrom koji se sam piše. Snimanje ê ÍČ spektra u smislu ispadanja gline ili prijenosa (u %) u frekvenciji (cm -1) ili trajanju trošenja (µm). Tipičan pogled na spektar prikazan je na sl.

IF spektri se najčešće mjere ovim redom:
1. Razchini govori najkorisniji za odabir spektra, jer u ovom slučaju postoje međumolekulske interakcije. U vezi s tim, da je u ÍH regiji glina poput govora, poput rozchinnika vicorista s najjednostavnijom strukturom, spektrom nekih od najjednostavnijih vrsta (minimalna količina samozadovoljstva), a najčešće - hotiriklornog ugljena, koji je više od 1300 cm -1.također sirkovoole, praktički bistre i niže od 1300 cm -1. Slijedom toga, nakon prepisivanja govora u tom drugom prodavaču, počinjemo zapisivati cijeli infracrveni spektar.
Za rozchinív zastosovuyt cilindrične kivete debljine 0,1 ÷ 1,0 mm iz vena iz slanih ploča. Potreban volumen za punjenje kivete je 0,1 - 1,0 ml pri koncentraciji 0,05 - 10%.
2. Tanki kupaći kostimi (<0,01 мм) жидкого вещества, помещенные между солевыми пластинами, удерживаемыми капиллярными силами.
3. Pasti, koji se pripremaju za praćku tvrdog kamena s vazelinskim uljem i stavljaju blizu tanke kuglice između ploča soli. Samo vazelinsko ulje, koje je sažeto u ugljikohidrate, intenzivno tamni u području od 2900 cm -1 i 1400 cm -1. Heksaklorobutadien se ponekad koristi za pripravu vicor pasta, otvor je veći od 1600 cm -1, a područje je 1250 ÷ 1500 cm -1, dakle u mirnim intervalima frekvencije, u kojima se glini vazelinsko ulje.
4. Čvrsti govori izgledati kao fini puder(0,5÷1,0 mg), temeljito pomiješan s prahom kalijevog bromida (~100 mg) i zatim stiskanje na poseban dodatak ispod škripca do "4,5 × 10 8 Pa tanka ploča.
5. Metoda oštećeno ukupno unutarnje vrenje(NVO):

Količina govora, koja je potrebna za ÍK spektar, bez obzira na metodu pripreme uzorka je 0,5÷2 mg.
Krhotine materijala za kivetu i solne ploče, oko nije krivo za osvetu. Metoda ÍCh-spektroskopije jedna je od najdostupnijih u laboratorijskoj praksi. Samo ga stavite u upotrebu, za odabir spektra potrebna vam je papalina.
Drugi tip spektra koji nosi informacije o koagulaciji u ovom rasponu, ê spektri kombinatorne rozsíyuvannya (KR).

Glavna im je značajka fiksacija dozhin hvil, što je važnije u vidljivom rasponu. Umovoy njihovo otrimannya ê vysokointensivny dzherel vysokomonohromaticheskogo vpromínyuvannya, često laser, i nekoliko linija atomskog spektra luminiscentne živine lampe niskog tlaka.
Spektar se smiruje zbog neopružnih interakcija fotona svjetlosnog snopa s govornim molekulama. Foton, prianjajući uz elektron molekule, može prenijeti još veću razinu molekularne energije, trošeći dio svoje energije. Linije koje se pojavljuju Stokesova . Močan zamah, ako se foton zalijepi s elektronom, koji je na visokoj molekularnoj energetskoj razini, i prebaci jogu na nižu orbitalu, gomilajući dio energije. Postoje linije koje su simetrične Stokesu i glavna linija (foton koji pada) i redovi anti-Stokes . Stoksivski redovi, tobto. manje energije, intenzivno, jer proces prijenosa energije fotona na elektron. Međutim, sve linije Ramanovog spektra su niskog intenziteta u homogenom svjetlu (gotovo 10 -7 u ukupnom intenzitetu ružičastog svjetla). Stoga su Ramanovi spektri fiksirani okomito na ravnu liniju budnog snopa. Registracija spektra se vrši kao i obično. S kim je bila glavna budna linija n 0 uspostavlja se niz uskih linija koje n i . Prema vremenu n 0 і n i vrijednosti Dn .
Pogled na spektar sličan je prikazu slike u ÍČ spektroskopiji. U modernim uređajima, buđenje ružičastog svjetla vibrira se monokromatskom laserskom promjenom, koja omogućuje distribuciju 1 ÷ 10 mg govora s ograničenim rasponom. Uzorak se može primijeniti kao čisti izvor ili kao prašak, kao i u krutom prahu.
Za pomoć naboja okrivljena je elektromagnetska kolivanija. Vidpovidno, í̈hnê poglanannya pov'yazane zí zmíschennyam zarídíví. Očito je što je ispravno glina u ÍČ regiji treba se susresti dovoljnim intenzitetom, poput polarnog jezika. U Ramanovim spektrima, intenzivan smog daje simetričnu koliju nepolarnih veza, oskílki razí važan dipolni moment, scho u procesu colivannya. Otzhe, na najjednostavnije načine koliacija se pojavljuje u IF spektrima, neaktivna u Ramanovim spektrima, i, očito, ali. Za simetrične molekule u IF spektrima postoji aktivna antifazna kolijacija, dok su u Ramanovim spektrima one u fazi. U svijetu je smanjena simetrija molekula bogato koncentrirana i intenzivno se očituje u onom drugom spektru. Također, IF i CR spektri se međusobno nadopunjuju, te se kombiniranom primjenom ovih metoda može izvući maksimum informacija o učestalosti koliviranja analiziranog govora.
Smugi u kolyalnyh rasponima podijeljeni su u dvije vrste. Karakteristično(važno valentinovo) smog, prisutnost takvih u spektru dovesti do prisutnosti preostalog govora pjevajućih strukturnih elemenata.
Karakteristično je tí colivannya, yakí želite b za jedan parametar (m r ili F ) istotno v_dryznyayutsya u glavnom colivingu S-J (odvajanje lakih atoma: S-N, O-N, N-N broj višestrukih veza).
Za colivannyju je karakteristično ležati uz zvuk pjevanja ja, otzhe, može postići stalnu učestalost u različitim govorima, budući da se mijenja manje od troha za rahunok interakcije s otopinom molekule.
Nekarakterističan smugi, koji zauzimaju površinu od 400÷1000 cm -1, pokazuju brojčane valentne pukotine, koje se ne pojavljuju C-C, C-N, N-O ta deformacija colivanya. Ovo područje je kolivan ugljičnog kostura molekule, jer oštro reagira na najmanje promjene u strukturi molekule. Nekarakteristična kolivanija koja čini glavni dio spektra i kožni govor čine vlastiti skup smoga koji se ne ponavlja. Ne postoje dva uzastopna enantiomera (optički antipodi), iako postoji nekoliko identičnih infracrvenih spektara (IR spektra). Tsim često koristi za uspostavljanje istovjetnosti govora, krhotina sbíg IH spektri ê usklađivanje dokazom identiteta preostalih uzoraka.
Vrahovyuchi, da u spektru jednog govora uvijek možete pronaći smugu, kao dan u spektru drugog, Mogućnost slične analize iznosa, kao i spektra komponenti u kući.
U isto vrijeme, može postojati pobjednička analiza puta vimiruvannya intenziteta močvara. Ako je već instaliran budovački govor, u nekarakterističnom području spektra vide se đakonije smugi do pjesama koliva.
Međutim, pred posljednji dan, stanite pred sljedeći zadatak - stavite kuću iza spektra. Na koji način mogućnost IH spektroskopije ne treba ponovno procjenjivati, sljedeći pobjednik je manje od apsolutno vrhunskih kriterija.
Socrema, podaci, uzeti iz vizure područja nižeg od 1500 cm -1, ne mogu se smatrati dokazom, već samo dokazom ozbiljnosti prisutnosti drugog strukturnog elementa. Prije pomilovanja brkova, možete prikazati varijacije strukturnih promjena (zocrema, odabrana konformacija i najbliže izoštravanje) malih promjena u vrijednosti karakteristične frekvencije.
Drugim riječima, Iz kolivalnyh spektra nema tragova uzetih informacija čija je pouzdanost upitna.
Za opis kolivatnih spektara najčešće se koriste sljedeće informacije:
Kolivannya zv'yazku S-N. Valentno pucanje C-H na velikom atomu ugljika pojavljuje se u području od 2800-3000 cm -1 . Za acikličke i netenzione cikličke strukture, n CH može imati ofenzivne vrijednosti (cm -1):
| CH 3 | 2962 cm -1 | 2972 cm -1 |
| CH 2 | 2853 cm -1 | 2926 cm -1 |
| CH | 2890 cm -1 |
Smugi je karakterističan, ali ne baš informativan, jer se u govoru bojite različitih zvukova S N , yakí, štoviše, mogu vzaêmodíyati među sobom. Zadimljene pahuljice su postavljene jedna na drugu, zadovoljavajući u području od 2800÷3000 cm -1 smugu, koje mogu imati slabo izražene maksimume. Za potrebe strukture govora smuga, oni se u tom slučaju mogu samo pocrveniti, jer u vodi ima malo atoma, na primjer, u polihaloalkanima. Prisutnost smoga u ovoj galusi je pomirenje dokaza prisutnosti atoma u govoru u vodi s najviše atoma ugljika.
Deformacija colivannya d CH , širenje u području od 1350÷1470 cm -1 , niske karakteristike, ali se može prikazati u spektru:
| CH 3 | 1375 cm -1 | 1450 cm -1 |
| CH 2 | 1475 cm -1 |
Karakteristično je dodavanje dvije metilne skupine na jedan ugljikov atom (geminalna supstitucija), što čini dva bliska maksimuma (dubleta) približno jednakog intenziteta u području 1370÷1385 cm -1.
Informativni sadržaj spektra može se povećati, zahvaljujući razlikama u frekvencijama cijepanja zvukova, kako bi se osvetile različite izotopske modifikacije atoma. Zocrema, često zamjenska deuterirana polovica, obogaćena deuterijem umjesto protijem.
U analizi spoluka, obilježenog deuterijem, još je karakterističnija smuga n CD 2100 ÷ 2160 cm -1 sadi se u regiji, depraktično u ostalim danima smuge.
Colivannya zv'yazku C=C. U z'ednannyah íz ízolovanim podvíynym zv'yazyk v c = c nalazi se na 1600-1680 cm -1 .
U cikličkim sustavima, posebno naponima, vrijednosti frekvencije su tri puta niže. Učestalost kolivana subvíyny zv'yazku postupno se povećava s povećanjem koraka njezine zamjene, na primjer:

U IF spektrima, simetrične supstitucije alkena (nepolarna supstitucijska veza) n S=S očituje se rojem slabog intenziteta, kao npr. u spektrima semestra (I) i (III); za asimetrično zamijenjenu viseću kariku (na primjer, z'ednannya II), intenzivno je završiti samodopadni. Raman spektri imaju colivanya C=C u vrijeme aktivnije, niže u ÍH spektru, i da li subwire ligation daje napetost (zvuk najintenzivniji u spektru) liniju. Smuha (smuha) može biti karakteristična za prisutnost govora veze podzemne željeznice. n=CH , mljeveno u području 3000-3100 cm -1 .
Deformacija colivannya d=CH može se prilagoditi za označavanje konfiguracije intercessora u slučaju viseće veze: za cis-izomere smrad se širi u području 650÷750 cm -1 , a za trans-izomere - u području 960÷970 cm -1 .
Na taj način, na temelju ovih kolyvalnyh spektra (osobito CR spektra), može se otkriti prisutnost izoliranog podsklopnog ligamenta u govoru i postoji slomljeno pjevanje vysnovke o prirodi zamjene.
Smuha n = C D još je karakterističniji (2200÷2300 cm -1) i omogućuje ubrizgavanje atoma deuterija, koji se nalazi s karikom lanca, poput atoma D s velikim atomom ugljika.
Colivannya pov'yazanih díênovih sustava.
Primivši novi sustav u području od 1500 ÷ 1650 cm -1, postoje dva samozadovoljstva, koja pokazuju dvije vrste valentnog kolanja - u fazi i u protufazi, na primjer: 
U cijeloj skupini smugova, cijepanje dynskih sustava u IF i Ramanovim spektrima značajno je intenzivno u odnosu na izolaciju podsklopivih veza, kao rezultat toga, dynski sustav može imati transpozicijsku konfiguraciju. U IC spektru je aktivnija kolikacija, kao i u Ramanovom spektru. U infracrvenom spektru simetričnih podjela (na primjer, butadien), intenzitet smoga može biti značajno nizak. Uvođenjem alkilnih supstituta u dienski sustav, vrijednosti frekvencija i prirodno se kreću. kolivannya n=CH u dienima se pojavljuju u istom području kao i u alkenima (3000÷3100 div -1).
Na taj način, prisutnost govora u dijagnostičkom sustavu lako se može pripisati imenima kollyalnyh spektra. Dodatkom podvarijantne veze s aromatskom jezgrom, frekvencija zvonjenja se pomiče u niskofrekventno područje (za 30 cm -1), čime se povećava intenzitet ovojnice. S povećanjem broja koplja, pojavom (u spektrima poliena) povećava se količina smoga. n S=S , štoviše, frekvencije njihovih zvukova se mijenjaju, a intenzitet se značajno povećava.
Kolivannya aromatski sustavi. Valentno pucanje C-Z-zvijezda benzenskog prstena daje dimni intenzitet na 1585-1600 cm -1 i 1400-1500 cm -1, tako da nisu zgodne za identifikaciju, jer je područje blizu kolivana n C =C. Broj n CH arena leži u području 3020-3100 cm -1; smradovi se manifestiraju u skupini smoga srednjeg intenziteta, ponekad više, niži u glinonosnim u istoj regiji n = CH alkenivi.
U spektrima aromatskih ploča prisutan je intenzivan smog netruležnih deformacijskih pukotina. S N u području 650÷900 cm -1. Ovo područje daje mogućnost određivanja količine i skladištenja supstituta u aromatskoj jezgri, kao i međusobnog skladištenja benzenskih prstenova u polinuklearnim aromatskim puževima. U pravilu, prisutnost jakog smoga u području 650-900 cm -1 ukazuje na prisutnost aromatske jezgre u govoru. Osim toga, u ovom galusiju se očituju zvukovi koli-ugljen-halogen, štoviše, smugi mogu zvučati visokog intenziteta: C-Cl (550÷850 cm -1), C-Br (515÷690 cm -1), C-I (500÷600 cm -1). Pozivanje zvuka C-F pojavljuju se u području skeletnih ligamenata S-J preteško ih je pratiti. Vykoristovuvat kolivanie zv'yazkív ugljen-halogen u svrhu halogena u pohranjivanju govora nije razuman (ê bezlične metode u najboljim i najtočnijim), ali za zaštitu industrijskih proizvoda i međuovisnost rezultirajućih mehanizama reakcija, može se dati izgled smoga.
Da bi se utvrdio položaj intercesora u aromatičnoj jezgri, područje od 1650 ÷ 2000 cm -1 odstupilo je od vicorist regije od 1650 ÷ 2000 cm -1 isključivo slabih prizvuka i nijansi više preklapanja. Smugi u ovom galuzi je ugar zbog prirode zamjene, postoji drugačiji obris. Površnost znakova je mala, a štoviše, ovo područje se preklapa zbog prisutnosti govora karbonilne skupine.
Spektri sudara najvažnijih heterocikličkih sustava mogu biti bogato složeni sa spektrima sličnim benzenu: na primjer, za furan, tiofen, pirol i piridin n CH 3010÷3080 cm -1 ta n C-C (kíltse) 1300÷1600 cm -1, štoviše, položaj smuga v C-C moguće je taložiti prema vrsti heterocikla i prirodi supstitucije. Have tsíy galuzí you can winknut víd dvoh to chotirioh swag. Snizite glavne frekvencije u spektrima najvažnijih heterocikla (cm -1)
Kolivannya zv'yazku ºS. Prisutnost veze dokazuje se rojem valentnih kolivana 2100 ÷ 2250 cm -1, jer imaju tsíy galuzí ínshí smogi su praktički svakodnevni. Smog srednjeg intenziteta, sa simetričnom supstitucijom u ÍCh spektru, može postati praktički neupadljiv, u Ramanovom spektru, smuga je aktivna i ima veći intenzitet od manje simetričnog alkina.
Kolivannya zv'yazku O-N. U visoko uzgojenim varijetetima, koji osiguravaju prisutnost međumolekulskih interakcija, hidroksilne skupine se očituju zamućenjem valentnih kolivana visokog intenziteta 3200-3600 cm-1. Ako hidrokso skupina sudjeluje u vodenoj vezi, tada se stvaranje tog karaktera linije počinje snažno taložiti u stupnju zračenja, jer. počevši mijenjati siloviti stalni poziv. Kao međumolekularna veza, čini se da je široka nestrukturirana smuga koja prelazi cijeli raspon od 3200÷3600 cm -1 . U pravilu se uočavaju intramolekularne vodene veze, što ukazuje na intenzivan smog od blizu 3500 cm -1, pomaknut u niskofrekventno područje, jednako velikim skupinama. Za jedinstvenost mogućnosti uspostavljanja međumolekulskih veza, sljedeći pobjednik bi trebao biti trgovac na malo niske polarnosti (u ugljikohidratima, CCl 4) i koncentracija manja od 5 × 10 -3 mol / l. Vile fenolni hidroksid očituje se ženskom valentnom coli 3600÷3615 cm -1 visokog intenziteta.
Deformacijsko cijepanje hidroksogrupa truljenja u području 1330-1420 cm -1 i malo za identifikaciju. Dimeri karboksilnih kiselina pojavljuju se u širokom intenzivnom smogu u području 1200÷1400 cm -1.
Kolivannya zv'yazku S-O. Zvijezda se manifestira u eterima i alkoholima u intenzivnoj maglici područja 1000÷1275 cm -1 . Sklopivi eteri u spektrima zamjenjuju dva smuga za C-O-C skupinu: simetrični coli 1020÷1075 (slabiji u IF spektru) i antisimetrični na 1200÷1275 cm -1 (slabiji u Ramanovom spektru). U tom se rasponu očituju samodopadnosti različitih skupina, a samodopadnosti su nekarakteristične, a najčešće je sam smrad najintenzivniji.
Colivannya zv'yazku Z = O. Valentno cijepanje karbonilne skupine prisutno je u spektrima različitih vrsta: samo aldehidi, ketoni, karboksilne kiseline i anhidridi. Ovo je visoko aktivan vrh u području 1650÷1680 cm -1 , inače je praktički dnevni. Ovo je jedna od najkarakterističnijih samodopadnosti, njezina prisutnost ili prisutnost može se pomiriti dokazom prisutnosti ili prisutnosti karbonilnih skupina. Specifični raspon manifestacije smoga leži u susidníh skupinama i skupinama, karbonil je uključen u jak, indukcijski učinak (-I) mijenja dugovječnost C \u003d O i, prema tome, povećava se snaga konstantne frekvencije . Za aldehide i ketone smuga oni su blizu 1710÷1750, za karboksilne kiseline - 1650÷1695,18 - 1865÷1875, bezvodne kiseline - 1740÷1790 i 1800÷1850 cm -1. Učinak dobivanja p-elektrona smanjuje učestalost koagulacije: u sustavima C=C-C=O i C 6 H 5 -C=Pro, smuga se miješa na oko 1665÷1685 cm -1 .
Na taj način, spektri ugljikovih polja omogućuju nam uzimanje velikog broja nedvosmislenih informacija, posebno gledajući druge smugove: za folding etere i anhidride - smuga C-O , amidiv - smuga N-H , spektri aldehida često imaju smuga skupinu SAN blizu 2695÷2830 cm -1 . Za bogate aldehide, ovaj ketonski spektar je zbroj glavnih i enolnih oblika.
Veze spektralnih manifestacija različitih grupacija u IH i Ramanovom spektru prikazane su u tablicama br. 2, u svrhu pojašnjenja posebnih tablica, koje dopuštaju veći skup frekvencija i dopuštaju dodavanje praktičnih skupova smugova u različitim područjima.
Tablica br. 2. Glavne frekvencije kolivana u ÍCh-spektroskopiji
| Frekvencija cm -1 | Intenzitet | priroda kolivani | Vrsta naloga | |
| 3620- 3600 | s., povn. | n VIN (besplatno) | Razvio asortiman alkohola | |
| 3600- 3500 | s., povn. | n VIN (glasovni) | Intramolekularne vodene veze u alkoholima | |
| s., povn. | (Viln.) | Istraživanje podrijetla prvih amida | ||
| 3400- 3350 | od. | n NH (besplatno) | Sekundarni amini, N-supstituirani amidi | |
| 3550- 3520 | s., povn. | n OH (slobodno) | Razrjeđenja kiselina | |
| 3500- 3400 | s., povn. | n NH2 (slobodan) | Primarni amen, amidi | |
| S. | (Viln.) | Razrijeđeni amidi | ||
| 3330- 3260 | od. | n ºCH | Jednosmjenski alkin | Alkani |
| 1370- 1390 | s., povn. | Nitrospoluky | ||
| 1280- 1200 | S. | n SOS | Preklopni zrak | |
| 1250- 1180 | od. | n C-N | Tercijarni amini (ArNR 2 , (RCH 2) 3 N) | |
| 1220- 1125 | S. | n C-O | Sekundarni, tercijarni alkoholi | |
| 1200- 1160, 1145- 1105 | s., povn. | n C-O | Ketali, acetali | |
| 1150- 1050 | S. | Efiri | ||
| 1085- 1050 | s., povn. | n C-O | alkohol | |
| 970- 950 | od. | d CH | Trans-alkeni | |
| 900-650 | S. | d CH | Areni | |
| 750- 650 | od. | d=CH | Cisdieni |
| Upišite zv'yazku ta z'ednan | Frekvencija cm -1 | ||
| -C=C- | |||
| alkeni | 1680- 1620 | ||
| cis-pokhídní | 1665- 1635 | ||
| trans-prijateljski | 1675- 1660 | ||
| ciklički | 1650- 1550 | ||
| po'yazaní | 1660- 1580 | ||
| -C=C=C- | |||
| aleni | 1970-1940 (kao) | ||
| 1070-1060 (ns) | |||
| -CºC- | |||
| Alkini | 2270- 2190 | ||
| -CºC-H | 2140- 2100 | ||
| ss=pro | |||
| Ketoni | alifatski | 1725- 1700 | |
| nepostojeći | 1690- 1660 | ||
| aril keton | 170- 1680 | ||
| dijarilketoni | 1670- 1660 | ||
| ciklički | 1780- 1700 | ||
| diketoni | a | 1730- 1710 | |
| b | 1640- 1635 | ||
| Aldehid | alifatski | 1740- 1720 | |
| nepostojeći | 1705- 1650 | ||
| aromatičan | 1715- 1685 | ||
| karboksilne kiseline | monomer | ||
| dimer | 1725- 1700 | ||
| nepostojeći | 1715- 1680 | ||
| aromatičan | 1700- 1680 | ||
| laktoni | 1850- 1720 | ||
| anhidridi | |||
U isto vrijeme, nakon promjene kolivalnog kampa molekule, mijenja se i taj kamp za omatanje joge. Promjena kolyvalny i obertalnyh stanív za proizvodnju viniknennya obertalno-kolyvalnyh spektra. Kolivalna energija molekula je oko stotinu puta veća od njezine energije omotača, što ne oštećuje kolivalnu strukturu molekularnih spektara. Superpozicija malih u smislu energije ukupnih kvanta na jednako velike u smislu energije kolivalnih kvantuma, pomicanje linija kolivalnog spektra u blisko infracrveno područje elektromagnetskog spektra i njihovo pretvaranje u samozadovoljne. Z tsíêí̈ uzrokuje obertal-kolivalni spektar, koji poserígaêtsya u bliskoj infrachervoníy dilyantsí, može biti linearno-glatka struktura.
Smuga kože takvog spektra ima središnju liniju (točkasta linija), čija je frekvencija određena razlikom u terminima molekule. Kontinuum takvih frekvencija čisti je spektar cijepanja molekule. Kvantno-mehanička proširenja, povezana s odlukama Schrödingerovog poravnanja kose s prilagodbama uzajamnog ubrizgavanja stanica za omatanje i udarca molekule, dovode se do obrata:
de í ê postíynimi vsím energíchnyh rivnív i depozit víd kolivalny kvantni broj.
de - postíyní, manje veličine, niže i. Zbog nedostatka parametara í, u jednakim količinama í, s najmanjim skladištima u ovim spívvídnenjah mogu znekhtuvat i jasno vidjeti okluzalno-kolivalnu energiju molekule, kao i zbroj kolivalne i obertalne energije zhorstkoy molekule, također na drugačiji način:
Cey viraz ljubazno prenosi strukturu spektra i smanjuje vjerojatnost da će se dogoditi pri velikim vrijednostima kvantnih brojeva ta. Pogledajmo obertalnu strukturu obertalno-kolivalnog spektra. Dakle, kada viprominuvanni molekule prelaze s viših energetskih razina na niže, au spektru se pojavljuju linije s frekvencijama:
tobto. za linijsku frekvenciju otvorenog kolivalnog spektra, može se napisati na sljedeći način:
Kombinacija frekvencija daje spektar otvorenog sudara. Prvi član u ovom slučaju jednak je spektralnoj frekvenciji, koja je posljedica promjene samo kolivalne energije. Gledali smo omotane linije samozadovoljstva spektra. Na granicama jednog smuga njezinoj tankoj otvorenoj strukturi dodijeljeno je više od vrijednosti otvorenog kvantnog broja. Za takvo samodopadno lice možete zapisati u oči:
Vídpovídno na pravilo vídbor Paulí:
cijela smuga je podijeljena u dvije skupine spektralnih serija, kao da se roztashovuyutsya duž obje strane. Tako je, tako je:
tobto. ako:
tada uzimamo grupu linija:
tobto. ako:
tada uzimamo grupu linija:
U trenucima prijelaza, ako molekula prijeđe s 3. otvorene linije na otvorenu energetsku razinu, skupina spektralnih linija određena je frekvencijama. Tsya skupina linija naziva se pozitivnim ili mekim smogom spektra, koji se temelji na z. Tijekom prijelaza, ako se molekula pomiče s th na energetsku razinu, otkriva se skupina spektralnih linija s frekvencijama. Tsya skupina linija naziva se negativni ili - meki smog spektra, koji se temelji na z. Tse tim, scho značenje, scho vídpovidaê nema fizičkog smisla. - i - gílki smuga, gledajući izvan vidokruga:
sastoje se od linija:
Ovim redoslijedom, dermalni smuga obertalno-kolivalnog spektra sastoji se od dvije skupine jednako udaljenih linija i između suicidnih linija:
za pravu netvrdu molekulu, koja je jednaka:
za frekvenciju linija - ta - g_lok smuga, otrimuemo:
Tragom te crte - i - orlovi se izvijaju i čuvaju ne jednakim razmacima, nego - strehe, koje se razilaze i - orlovi, koji se približavaju odlukama pjevanja smuga. Na taj se način kvantna teorija molekularnih spektara pokazala korisnom pri dešifriranju spektralnih smogova u bliskom infracrvenom području, tumačeći ih kao rezultat jednosatne promjene ukupne i kolivalne energije. Značajno je da su molekularni spektri vrijedan izvor informacija o budućnosti molekula. Ostvarujući molekularne spektre, moguće je zamijeniti različite diskretne molekule energetskih stanica i na temelju dobivenih podataka napraviti pouzdane i točne zaključke o kretanju elektrona, okretanju i rotaciji jezgra u molekuli, a također dobiti točne informacije o snažnom djelovanju između atoma u molekulama, međustanjima i geometriji disocijacija jezgri u molekulama, energija disocijacije same molekule i in.
Molekularni spektri- spektri glinenja, viprominyuvannya ili rozsiyuvannya, koji se okrivljuje za kvantni prijelazi molekule iz jednog energetskog. Bit ću do sljedećeg. M. s. određeni su skladištem molekule, njenom strukturom, karakterom kem. zv'yazku da vzaêmodíêyu s vanjskim. polja (i, kasnije, s izoliranim atomima i molekulama). max. karakterističan za pojavu M. sa. rijetke molekularne plinove, ako svaki dan proširenje spektralnih linija tijesnost: takav je spektar sastavljen od uskih linija Dopplerove širine.
Riža. 1. Shema jednake energije dvoatomne molekule: aі b-elektronički jednako; u" і u"" - kolivatní kvantni brojevi; J"і J"" - otvoreni kvantum brojevima.

U molekuli postoje do tri sustava jednake energije - elektronski, kolivalni i otvoreni (slika 1), M. s. sastoje se od ukupnosti elektroničkih, kolivan. vrtim se. spektra i leže u širokom rasponu el-magn. hvil - vrsta radijskih frekvencija do X-zraka. sferni spektar. Učestalosti prijelaza između zavoja. pri jednakim razinama energije zvuk se troši u mikrovalnom području (na ljestvici mikrovalnih brojeva 0,03-30 cm-1), učestalost prijelaza između kolibata. linije - u ÍCh-području (400-10 000 cm -1), a frekvencije prijelaza između elektronskih linija - u vidljivom i UV području spektra. Tsei podíl umovny, na to često twist. kretati se dalje iu ÍCh-regiju, colivannya. prijelaz - u vidljivom području, a elektronički prijelazi - u ÍČ-području. Ozvučite elektroničke prijelaze popraćene promjenom zvuka. energija molekule, a pri koliv. prijelazi mijenjaju i omotaju. energije. Za to se elektronički spektar najčešće prikazuje sustavom elektroničkih oscilacija. samodopadno, štoviše, s velikom raznolikošću zgrada, čini se da ih obavija spektralna oprema. strukture. Intenzitet linija i samozadovoljstva u M. s. označava imovirnistyu sličnog kvantnog prijelaza. max. intenzivne linije potvrđuju dopušteni prijelaz prema pravilima. Sve do M. s. vidi također Auger spektre i X-zrake. spektri molekula(Članci se ne vide; div. Augerov učinak, Augerova spektroskopija, spektri X-zraka, spektroskopija X-zraka).
Elektronski spektri. Čisto elektronički M. s. vinikayutsya kada se mijenja elektronska energija molekula, pa kada tsmu ne mijenja colivan. vrtim se. energije. Elektronički M. s. posterígayutsya kao u glini (spektri gline), tako u vipprom_nyuvanni (spektri). Na elektroničkim prijelazima zvuči električna promjena. . Jedva. dipolni prijelaz između elektroničkih stanja molekule tipa G "
ta G ""
(Div. Simetrija molekula) je dopušteno, poput izravnog tvira G "
G ""
zamijeniti tip simetrije uzimanjem jedne od komponenti vektora dipolnog momenta d
. U spektrima glinjenja postoje znakovi prijelaza iz glavnog (ukupno simetričnog) elektroničkog mlina u buđenje elektroničkog mlina. Očito je da za stvaranje takvog prijelaza tipa simetrije pobuđenog dipolni moment može pasti. T. do. Ako dipolni moment ne leži u spinu, tada se tijekom elektroničkog prijelaza spin treba sačuvati, tako da je moguće prolaziti samo između mlinova s istim mnogostrukošću (interkombinacija ograde). Ovo se pravilo, međutim, krši
za molekule s jakom spin-orbitalnom interakcijom, što može dovesti do interkombinacijski kvantni prijelazi. Kao rezultat takvih prijelaza, na primjer, okrivljuju se spektri fosforescencije, koji izgleda ukazuju na prijelaze iz pobuđenog tripletnog mlina u glavni. jednogodišnji mlin.
Molekule na različitim Elektronički postaju često različiti geom. simetrija. U takvim slučajevima um G "
G ""
G d može se koristiti za skupinu točaka konfiguracije niske simetrije. Međutim, s različitom skupinom permutacije-inverzije (PI), ovaj problem ne treba kriviti, jer se PI grupa za sva stanja može uzeti ista.
Za linearne molekule simetrije Z hu vrsta simetrije dipolnog momenta G d= S + (dz)-P( d x, d y), tada vam je dopušteno ići preko S + - S + , S - - S - , P - P tada. pupoljak. s dipolnim momentom prijelaza, ravnajući se duž osi molekule, i prijelazi S + - P, P - D tada. e. s momentom prijelaza, uspravljajući se okomito na os molekule (značaj položaja div. u st. Molekula).
Ymovirnist NA električni dipolni prijelaz s elektronske razine t na elektroničku valutu P, pídsumovana na svim kolivalno-overt. jednako elektronskih jednakih t, označava f-loy:
matrični element dipolnog momenta za prijelaz n-m,y hr i y em- hvilyoví f-tsíí elektronív. Integralni koeficijent. poglinannya, koja se može eksperimentalno ispitati, prepoznaje viraz
de N m- Broj molekula po pm. postati m, v nm- Prijelazna frekvencija tP. Često se karakteriziraju elektronički prijelazi
Autor Kemijske enciklopedije r.n. I.L.KnunyantsKOLIVANI SPEKTRI, movlyav. spektri uvećani kvantnim prijelazima između molekularnih energetskih razina. Eksperimentalno poserígayutsya kao ÍČ spektri poglanannya i kombinacije spektra. rozsiyuvannya (KR); raspon fluktuacijskih brojeva ~10-4000 cm -1 (frekvencije pulsacijskih prijelaza 3 . 10 11 -10 14 Hz). Swing. jednake energije dodjeljuju se kvantizaciji kolateralnog kretanja atomskih jezgri. Dvovolumenske molekule. Najjednostavnije se dvoatomna molekula prikazuje modelom dviju točkastih masa m 1 i m 2 koje međusobno djeluju s jednako važnom razlikom r e među njima (dvostruka veza), a pulsiranje jezgri smatra se skladnim i opisuje se izrazom jedinica, koordinata q = rrr e, de internuklearno postolje. Taloženje potencijalne energije kolyvalny ruh V víd q određeno je obližnjim harmonijama. oscilator [materijalna točka stupa s induciranom masom m \u003d m 1 m 2 / (m 1 + m 2)] kao funkcija V \u003d l / 2 (K eq 2), de K e = (d 2 V / dq 2) q \u003d 0 - harmonije. snaga je jaka 
Riža. 1. Odlaganje potencijalne energije V harmonija. oscilator (isprekidana krivulja) i prava dvoatomna molekula (sucilarna krivulja) u internuklearnoj liniji r (r s jednako važnim vrijednostima r); vodoravne ravne linije označavaju kolivalní rivní (0, 1, 2, ... vrijednost kolivalnog kvantnog broja), okomite strelice - deakí kolívalní prijelaze; D 0 je energija disocijacije molekule; osjenčano područje odgovara sucilijanskom spektru. molekule (isprekidana krivulja na sl. 1).
Vidpovidno na klasiku. mehanika, harmonijska frekvencija. vagon ![]() Kvantno-mehanički pregled takvog sustava daje diskretan niz čak udaljenih energetskih jednakosti E(v)=hve (v+ 1/2), de v = 0, 1, 2, 3, ... - kvantni broj, v e - harmonije. kolivalna postala molekula (h - postala Planck). Pri prolazu između sidijalnih linija, prema pravilu selekcije D v=1, foton energije hv= DE=E(v+1)-E(v)=hv e (v+1+ 1/2)-hv e ( v + 1 / 2) = hv e, pa je frekvencija prijelaza između to dvoje ista, i ista, štoviše, frekvencija prijelaza između to dvoje je ista, a klasični frekvencija harmonija. kolivan. To v e nazivamo i skladnim. frekvencija. Za prave molekule krivulji potencijalne energije nije pripisana kvadratna funkcija q, odnosno parabola. Swing. jednaki daedali su bliži blizini intermolekularne disocijacije molekule u anharmonijskom modelu. Oscilator je opisan jednak: E(v)=, de X 1 - prvi je postao anharmonijski. Učestalost prijelaza između sadržajnih jednakih nije prekoračena, a štoviše, moguće je prijeći preko koji su u skladu s pravilima odabira D v = 2, 3, .... Učestalost prijelaza iz jednakih v = 0 do jednakog v = 1 naziva se glavnom ili osnovnom frekvencijom. Idući od jednakog v = 0 do jednakog v> 1 dobivaju se tonske frekvencije, a idući od jednakog v> 0 daju takozvane vruće frekvencije. U IF spektru dvoatomnih molekula gline, kolivalne frekvencije opažene su samo u heteronuklearnim molekulama (samo HCl, NO, CO), štoviše, pravila odabira mijenjaju se promjenom njihovih električnih. dipolni moment kod kolivacija U Ramanovim spektrima, frekvencije kolivacije promatraju se za sve dvoatomne molekule, i homonuklearne i heteronuklearne (N 2 , O 2 , CN í itd.), budući da su za takve spektre pravila odabira određena promjenom polarizabilnosti molekula kod colivinga. Vychayutsya s KOLIVANI SPEKTAR str. harmonije. Konstanta K e i v e, stalna anharmoničnost, kao i energija disocijacije D 0 važne su karakteristike molekule, koje su neophodne za zokremu, za termokemijske ruže. Proučavanje kolivalno-overtalnih spektara plinova i para omogućuje određivanje obertalnih post-V (div. obertalnih spektara), momenata tromosti i internuklearnih stanja dvoatomnih molekula. Bogate atomske molekule promatraju se kao sustav povezivanja točkastih masa. Swing. ruh jezgre schodo jednak položaj s nenasilnim središtem mase bez omatanja molekule kao cjeline za opisivanje zvuka vikoristannyam tzv. ekst. prirodni koordinate q i , koje se biraju za promjenu duljine veza, valentnih i diedarskih bridova prostora, modela molekule. Molekula koja se sastoji od N atoma ima n=3N - 6 (za linearnu molekulu 3N - 5) stupnjeva slobode cijepanja. Prostor ima koordinate q i sklopive kolike jezgri mogu se detektirati s istim kolivanima, kožom s frekvencijom pjevanja v k (k uzima vrijednosti od 1 do n), s kojima se sva priroda mijenja. koordinate q i kada su amplitude q 0 i í dodijeljene za th koagulaciju faza. Takva kolivanija naziva se normalnom. Na primjer, triatomska linearna AX 2 molekula može imati tri normalne kohezije:
Kvantno-mehanički pregled takvog sustava daje diskretan niz čak udaljenih energetskih jednakosti E(v)=hve (v+ 1/2), de v = 0, 1, 2, 3, ... - kvantni broj, v e - harmonije. kolivalna postala molekula (h - postala Planck). Pri prolazu između sidijalnih linija, prema pravilu selekcije D v=1, foton energije hv= DE=E(v+1)-E(v)=hv e (v+1+ 1/2)-hv e ( v + 1 / 2) = hv e, pa je frekvencija prijelaza između to dvoje ista, i ista, štoviše, frekvencija prijelaza između to dvoje je ista, a klasični frekvencija harmonija. kolivan. To v e nazivamo i skladnim. frekvencija. Za prave molekule krivulji potencijalne energije nije pripisana kvadratna funkcija q, odnosno parabola. Swing. jednaki daedali su bliži blizini intermolekularne disocijacije molekule u anharmonijskom modelu. Oscilator je opisan jednak: E(v)=, de X 1 - prvi je postao anharmonijski. Učestalost prijelaza između sadržajnih jednakih nije prekoračena, a štoviše, moguće je prijeći preko koji su u skladu s pravilima odabira D v = 2, 3, .... Učestalost prijelaza iz jednakih v = 0 do jednakog v = 1 naziva se glavnom ili osnovnom frekvencijom. Idući od jednakog v = 0 do jednakog v> 1 dobivaju se tonske frekvencije, a idući od jednakog v> 0 daju takozvane vruće frekvencije. U IF spektru dvoatomnih molekula gline, kolivalne frekvencije opažene su samo u heteronuklearnim molekulama (samo HCl, NO, CO), štoviše, pravila odabira mijenjaju se promjenom njihovih električnih. dipolni moment kod kolivacija U Ramanovim spektrima, frekvencije kolivacije promatraju se za sve dvoatomne molekule, i homonuklearne i heteronuklearne (N 2 , O 2 , CN í itd.), budući da su za takve spektre pravila odabira određena promjenom polarizabilnosti molekula kod colivinga. Vychayutsya s KOLIVANI SPEKTAR str. harmonije. Konstanta K e i v e, stalna anharmoničnost, kao i energija disocijacije D 0 važne su karakteristike molekule, koje su neophodne za zokremu, za termokemijske ruže. Proučavanje kolivalno-overtalnih spektara plinova i para omogućuje određivanje obertalnih post-V (div. obertalnih spektara), momenata tromosti i internuklearnih stanja dvoatomnih molekula. Bogate atomske molekule promatraju se kao sustav povezivanja točkastih masa. Swing. ruh jezgre schodo jednak položaj s nenasilnim središtem mase bez omatanja molekule kao cjeline za opisivanje zvuka vikoristannyam tzv. ekst. prirodni koordinate q i , koje se biraju za promjenu duljine veza, valentnih i diedarskih bridova prostora, modela molekule. Molekula koja se sastoji od N atoma ima n=3N - 6 (za linearnu molekulu 3N - 5) stupnjeva slobode cijepanja. Prostor ima koordinate q i sklopive kolike jezgri mogu se detektirati s istim kolivanima, kožom s frekvencijom pjevanja v k (k uzima vrijednosti od 1 do n), s kojima se sva priroda mijenja. koordinate q i kada su amplitude q 0 i í dodijeljene za th koagulaciju faza. Takva kolivanija naziva se normalnom. Na primjer, triatomska linearna AX 2 molekula može imati tri normalne kohezije: 
Colivanya v 1 naziva se simetrična valencija colivanny (istezanje veza), v 2 - deformacija colivanny (promjena valencije kut), v 3 antisimetrična valencija colivanny. U presavijenim molekulama, one druge su komprimirane. normalno cijepanje (zamjena dvostranih rezova, torzijsko cijepanje, pulsacije ciklusa tanko.). Kvantizacija kolivalne energije bogate atomske molekule u aproksimaciji bogate atomske harmonije. dovesti oscilator na sljedeći, sustav kolyvalnyh rívnív energije:
de v ek - harmonije. kolivne postíyní, v k - kolívíní kvantni broj, d k - koraci virodzhennja ívnja energije na k-tom kolívíní kvantnom broju. Glavni frekvencije u KOLYUVAL SPEKTRU str. opremljena prijelazima s nulte razine [sve v k \u003d 0, kolivalna energija na razini, koje karakteriziraju ![]()
takvi skupovi kvantnih brojeva v k , u kojima je samo jedan od njih jedan 1, a ostatak je jednak 0. Yak i u slučaju dvoatomnih molekula, u anharmon. Susjedni također mogu biti prizvuci i "vrući" prijelazi i, štoviše, tzv. kombinacija, ili skladišta, prijelazi za sudjelovanje jednakih, za koje su dva jednaka nuli dva ili više kvantnih brojeva v k (slika 2). 
Riža. 2. Sustav kogeneracijskih članova E/hc (cm"; c - intenzitet svjetlosti) molekule H 2 Pro i aktivnog prijelaza; v 1 , v 2 . v 3 - kvantni brojevi.
Tumačenje i zastosuvannya. KOLIVANI SPEKTRI str. bogate atomske molekule odlikuju se visokom specifičnošću i predstavljaju složenu sliku, iako broj eksperimentalno čuvanih smugova može biti znatno manji od mogućeg broja, što teoretski potvrđuje prijenos jednakih na skup jednakih. Zvuk glavne frekvencije pokazuju intenzivniji smog u SPEKTRU VIBRACIJA sa. Pravila za odabir i promjenu prijelaza u ÍČ i KR spektrima različitih, krhotina pove'yazaní vídpovídno na zmin elektrich. dipolni moment i polarizabilnost molekule u normalnoj koži coli. Stoga se pojava ovog intenziteta smugova u IH i Ramanovim spektrima na drugačiji način taloži u tipu simetrije kolivana (veličina promjene molekule, koja je posljedica rezultata kolivanja molekule). jezgre, na radnu simetriju, koja karakterizira jednako važnu konfiguraciju). Deyakí zí smoog KOLINELNÍ SPECTRI str. mogu se ispitati samo u HF ili Ramanovim spektrima, drugi - s različitim intenzitetima u oba spektra, a eksperimentalno se ne ispituju. Dakle, za molekule koje nemaju simetriju, ali mogu imati nisku simetriju bez središta inverzije, sve osnovne frekvencije se promatraju s različitim intenzitetom u oba spektra, za molekule s centrom inverzije, postoje slične frekvencije, koje se boje da ne ponoviti u ogradi CR); Učinci frekvencija mogu biti vidljivi u oba spektra. Zato je najvažnije od zastosuvan KOLIVALNY SPECTRUM str. - Određivanje simetrije molekule iz određivanja IH i Raman spektra, redoslijed redova ín. Eksperiment. danich. Tražeći modele molekule s različitom simetrijom, moguće je teoretski razviti modele kože, koliko se frekvencija u ÍCh i Raman spektru može posterizirati i predstaviti eksperimente. dannymi robiti vídpovídny vybír modelí. Ako želite kožu normalnu colivannya, u svrhu, ê kolyvalnym žuriti sve molekule, deyakí z njih, posebno u velikim molekulama, može većina zachípati manje od k.-l. fragment molekule. Amplituda pomaka jezgri, koja ne ulazi u cijeli fragment, još je manja za takvo normalno cijepanje. Na čemu se temelji široko vikoristovuêtsya u strukturnoj analizi. koncept tzv. grupnih ili karakterističnih frekvencija: iste funkcionalne skupine ili fragmenti koji se ponavljaju u molekulama različitog spola karakteriziraju približno iste frekvencije u VIBRACIONOM SPEKTRU s. (Istina, što je uvijek s visoka razina pouzdanosti). Na primjer, karbonilnu skupinu karakterizira čak i intenzivan smog u IF spektru gline u području od ~1700(b 50) cm -1, koji se može vidjeti prije valentnog kolivana. Treba otkriti prisutnost smoga gline u sferi spektra, ali nema grupe u molekuli preostalog govora. Upravo u taj sat nazočnost dr.sc. smog u označenom području još nije jednoznačan dokaz prisutnosti karbonilne skupine u molekuli, tako da se u ovoj galusi učestalosti drugih molekularnih cijepanja mogu pojaviti na drugačiji način. Dakle, strukturna analiza i označavanje konformacija i frekvencija vibracija funkcija. skupine su krive za spiralu na papalini karakteristika. frekvencije, a peredačuvanu strukturu molekule treba potvrditi podacima u. metode (div. Structural chemistry). Ísnuyut dovídniki, yakí místjat numeričke strukturno-spektralne korelacije; ê također banke podataka i napredni programi za informacijske sustave i strukturnu analizu. Doslídzhen íz vekoristannyam EOM. Ispravno tumačenje KOLIVAL SPEKTRA str. pomoć isotopic. supstitucija atoma, što će dovesti do promjene u frekvencijama zvonjenja. Dakle, zamjena vode deuterijem dovodi do promjene frekvencije X-H valentne fuzije približno 1,4 puta. S izotopom Zamjena konstante snage molekula K je pošteđena. Ísnuê broj izotopa. pravila koja dopuštaju uvođenje frekvencija kolivinga do najmanje vrste simetrije kolivinga, funkcionalne skupine itd. Model rozrahunki KOLIVALNI SPECTRY str. (frekvencije i intenziteti smoga) kada se daju konstante snage, poput vicorista za određenu strukturu molekula, izravno se dodaju zahtjevima kolivalne spektroskopije. Potrebni za ove silne postojane i takozvane elektrooptičke parametre (dipolne momente veza, komponente tenzora polariziranosti i dr.) uključene su u niz istraživanja za strukturu molekula ili podržavaju rješenja suprotnog zadatka, koji se utvrđuju u skupu silnih stalnih i elektrooptičkih parametara mnogoatomnih molekula. , intenzitet i in. Eksperiment. danich. Definiranje skupa osnovnih frekvencija KOLIVAL SPEKTAR str. neophodan je za izračun kolativnih doprinosa termodinamičkoj funkciji govora. Ovi podaci su ugrađeni u rozrahunka kemijskog rívnovag i za modeliranje technol. procesima KOLIVANI SPEKTRI str. dopustiti vivchati ne samo vnutrímol. dinamika i međumolekularne interakcije. Iz njih uzeti podatke o površinskoj potencijalnoj energiji, unutarnjoj. Omot molekula, šačica atoma s velikim amplitudama. Iza KOLIVAL SPECTRA str. doslídzhuyut udruživanje molekula i struktura kompleksa različite prirode. KOLIVANI SPEKTRI str. leže u agregatnom stanju govora, što vam omogućuje uzimanje informacija o strukturi različitih kondenzacija. fazama. Učestalosti prijelaza kolika jasno su zabilježene na molu. oblici s čak i malim satom života (do 10 -11 s), na primjer, za konformere na visini potencijalne barijere u kilki kJ / mol. Tom KOLIVALNI SPECTRIES str. zastosovuyut za doslídzhennya konformacijske izomerije i shvidko vstanovlyuyutsya jednaki. O vikoristannya KOLIVALNI SPECTRY str. za analizu kalkulusa i u. ciljevima, kao i o suvremenoj tehnologiji kolivalne spektroskopije div. u čl. Infracrvena spektroskopija, kombinatorna spektroskopija.
Poglinannya u području od 10 2 - 10 3 cm -1 (ÍČ - regija) okružena je prstenastim prijelazima pri konstantnom elektronskom stanju molekule; slični spektri nazivaju se kolivalnymi. Točnije, njihov sljedeći bi se nazvao kolivalno-rotacijski, tj. do. Promjene u kolivalnoj energiji molekule kada se gline u galusu prate, zvuk, promjena i energija omotača.
h \u003d E ′ - E ″ \u003d (E vr ′ + E kobilica ′) - (E wr ″ + E kobilica ″) . (2.104)
Kolivalni spektar je presavijen od niske do daleko jedne vrste jednog roja, intenzitet ovih povećanja u broju prehlada naglo se mijenja (Sl. 2.22). Persha, najintenzivniji smuga, naziva se glavni smuga, ili glavni ton. Neka se 1. i 2. prizvuk razvaljaju. Intenzitet nadolazećih rojeva svjetla je manje izražen, pa ni 3. i 4. prizvuk za više molekula potomstva ne ulaze.
Kožna smuga u spektru je sklopiva i kada se snima na prilogu s velikom razdílnoy zdatnístyu prilad je podijeljena na niz malih linija. Pojava takve fine strukture povezana je s govorom na plinskoj postaji. Položaj smoga u nizu karakteriziraju kolateralni prijelazi, a finu strukturu linije kože karakteriziraju otvoreni prijelazi.
Da bismo razumjeli prirodu takvog spektra, pogledajmo stražnji dio glave više od kolyvalny ruh i kolyvalny prijelaza, apstrahirajući se od omotača molekula, tj.
h \u003d E kobilica - E kobilica. (2.105)
Pulsiranje dvoatomne molekule iz pogleda klasične mehanike moguće je kao periodična promjena između jezgri.

Vidljivo s Hookeovim zakonom, ono što je opisano harmonično zvonjenje, sila koja okreće jezgre u jednake položaje proporcionalna je sili jezgri iz jednakog položaja:
f = - kq, (2.106)
de k - Snaga je brza;
q je kokoordinata; q \u003d r a + r b \u003d r - r e.
Hookeovo izjednačavanje vrijedi samo za male pomake jezgri, pa ako je q >> r e, između pri q = 0.
Dvoatomna molekula konstantne snage ima vrijednost koja karakterizira opružnost veze i brojčano jače sile koje tvore (istežu ili stiskaju) vezu po jedinici duljine f = k pri q = 1.
Elementarni robot opružne sile:
dA = -fdq. (2.107)
Radi jednakosti (2.106) moramo:
dA = - kq dq. (2.108)
Nakon integracije u granicama
 (2.109)
(2.109)
za potencijalnu energiju dvoatomne molekule potrebno je:
u = A = 1/2 kq2. (2.110)
Z jednako (2.110) viče to
k = (d 2 u / dq 2) q = 0. (2.111)
Na taj način, za male zsuvív potencijalna energija je kvadratna funkcija víd q = r - r e. Krivulja u-q ili u-r je parabola, a konstanta snage k karakterizira zakrivljenost parabole blizu minimuma.
Kada se potkrijepi virazom (2.110) Schrödingerovim izjednačenjem
2 kobilica + (8 2 / h 2) (E kobilica - u) kobilica \u003d 0 (2.112)
A vrhunac ove razine jednak je prirodnim vrijednostima kolivalne energije dvoatomske molekule kao harmonijskog oscilatora:
E kíl \u003d h (v + 1/2) , (2.113)
de v- kvantni broj koji prihvaća vrijednosti tsilih pozitivnih brojeva, počevši od nule (v = 0, 1, 2, 3.......);
0 - Vlasna frekvencija vibracija vibratora.
Vlasnički kapital (2.113) može se podnijeti na drugačiji način:
E kíl \u003d hc e (v + 1/2) , (2.114)
de e je visokofrekventni broj (kolivalna konstanta), koji karakterizira frekvenciju oscilacija, dovedenu na minimum potencijalne krivulje, pa je ta frekvencija, po pravilu klasične mehanike, molekula mala za beskonačno malu amplitudu oscilacije (q = 0, r = re). Vrijednost e je prikazana u m -1 ili cm -1. Vaughn je molekularno brz. Bilo da se radi o dvoatomnoj molekuli, karakterizirana je u elektronskom stanju kože stvarnim konstantnim vrijednostima e.
Jednadžba (2.114) pokazuje kvantizaciju kolivalne energije i nulte energije oscilatora pri v = 0:
E 0 kíl \u003d hc e / 2. (2.115)
Tsya energija nije jednaka nuli. Energija harmonijskog oscilatora raste izravno proporcionalno kvantnom broju v, što ukazuje na sustav jednakih i udaljenih kvantnih jednakosti. S obzirom na kvantno-mehanička pravila odabira za harmonijski oscilator, moguće je prijeći od v = 1. Kada je svjetlo prigušeno, ono se mijenja na +1, povećava se energija i amplituda koliviranja.
Međutim, model harmonijskog oscilatora treba prilagoditi na položaj koji je izvrstan za eksperimentalne podatke:
1) Ekil u okviru ovog modela može biti sjajan kao i uvijek. Na taj je način kemijska veza u molekuli bezgranično elastična i yogo, širenje slova bi nemoguće. Znamo što nije u redu;
2) za harmonijski oscilator u spektru gline samo je jedna greška bojati se smuge, što je vidljivo iz pravila za odabir i ekvivalenciju jednakosti zvona (sl. 2.23 a). Međutim, spektar stvarne dvoatomne molekule je sumnjiv kao papalina smoga.

Riža. 2.23 Krivulje potencijalne energije (a) i akumulacija kolativne energije E coil v_d V coil (b) za harmonijski oscilator
To ne znači da su prave molekule harmonijski oscilatori. Harmonična blizina s njima može se pobijediti samo za minimalne zvukove jezgri iz tabora jednakih, tobto. pri malim vrijednostima kolivalnog kvantnog broja (v = 0; 1).
Za prave dvoatomne molekule funkcija U(r) nije parabola, a sila koja rotira nije strogo proporcionalna pomaku jezgri. Cijena za model anharmonijski oscilator, Za koju je prikazana krivulja potencijalne energije, kao što je prikazano na sl. 2.24.
Za približan opis krivulje potencijalne energije, Morseova funkcija je:
u = D e 2 (2,116)
de D e - Energija disocijacije;
je konstantan za cijelu molekulu.

Riža. 2.24 Krivulje potencijalne energije (a) i akumulacije kolativne energije E kíl víd V kíl (b) za anharmonijski oscilator
S varijacijom Schrödingerove jednadžbe za dvoatomnu molekulu, ako je u(r) izraženo Morseovom funkcijom, vrijednosti kolivalne energije Ekil opisane su binarnim članom:
E kíl \u003d hc e (v + 1/2) - hc e x e (v + 1/2) 2, (2.117)
de x e - Koeficijent anharmoničnosti, koji karakterizira varijaciju u harmoniji, a vrijednost je promjenjiva, štoviše
e >> e x e > 0. (2.118)
Jednadžba (2.117) može se uzeti za anharmonijski oscilator nulte energije (de v = 0):
E 0 \u003d 1/2 hc e - 1/4 hc e x e. (2,119)
Z jednako (2.117) vyplyvayut vysnovki:
ugar Ekil víd v nije linearan;
kolivalní quantívní konvergirati zí zbílshennyam v.
Doista, razlika u energiji koliviranja s porastom kvantnog broja za jedan mijenja se s porastom V:
E v+1 v \u003d E (v + 1) - E (v) \u003d hc [ e - 2 e x e (v + 1)] . (2.120)
Poznajemo prije svega slične funkcije (2.117):
E v = hc e (V + 1/2) – hc e x e (V + 1/2) 2 , (2.121)
dE V /dV = hc [ e - 2 e x e (V + 1/2)] , (2.122)
d 2 E V /dV = –2hc e x e< 0 . (2.123)
Viraz provjeriti može li krivulja E v -V biti maksimalna (Sl. 2.16, b) i kolivní rívní konvergirati deyakogo vrijednost V max. , Što možete maksimalno znati:
dE V / dV = 0 (2,124)
dE V /dV = hc[ e - 2 e x e (V max + 1/2)] = 0 , (2.125)
V max \u003d ( e / 2 e x e) - 1/2, (2,126)
V max = 1/2x e - 1/2
. (2.127)U ovom rangu, glavna granica diskretnih kolivnyh jednaka je i maksimalna energija anharmonijskog oscilatora E V, max. Kako molekule generiraju kolativnu energiju E V > EV, max, doći će do disocijacije, kao što se može vidjeti iz krivulje potencijalne energije (slika 2.16, a).
Rozrakhovaní za formulu (2.127) vrijednost V max za većinu molekula postaje nekoliko desetaka, za deyakah - do druge stotine.
Pravila odabira:
kao za harmonijski oscilator V = 1, tada za anharmonijski oscilator kvantno-mehanička pravila dopuštaju odabir je li prijelaz: V = 1, 2, 3 pravedan;
može se opisati bez obzira na to je li govor (polarni i nepolarni).
Zamjenom vrijednosti V, e , x e izjednačenja (2.117) moguće je sastaviti shemu dopuštenih izjednačenja energije kogeneracije.
Riža. 2.25 Shema dopuštenih plaćanja za energetski život.
Najveći broj dvoatomnih molekula, kolivalni prijelaz 01, iznosi 10 - 100 kJ/mol. Značajno veća od prosječne energije toplinske energije molekula plina pri temperaturi od 18 - 25 pro C (RT = 2,5 kJ/mol pri 298 pro K). Stoga je važno da se iz temperature što veći broj molekula prebaci na nižu energetsku razinu, tj. V″=0.
Pravilo odabira omogućuje vam da unesete poravnanje za sve frekvencije, koje su zaštićene spektrom i unesite kolivalni spektar:
\u003d EV / hc \u003d e (V + 1/2) - e x e (V + 1/2) 2. (2,128)
Zamjenom vrijednosti V i V u jednadžbi (2.128) i uzimanjem razlike između brojeva, možemo uzeti:
V″ 0 \u003d [ e (V′ + 1/2) - exe (V ”+ 1/2) 2] - [ e (V ″ + 1/2) - exe (V ″ + 1/2) 2].(2.129)
Nakon transformacije:
\u003d (V "- V ″) [ e - e x e (1 + V" + V ″)] . (2.130)
Vrahovyuchi, scho V’=0, moguće je uzeti viraz za hvilyovyh brojeve, samo je eksperimentalno promatrati niz prijelaza, indikacije za malog i sam prijelaz V ″ (0) V ":
\u003d V "[ e - e x e (1 + V")] , (2.131)
de V" = 1, 2, 3, ... V max.
Za prijelaz 01 potrebna je najmanja energija. Tse vídpovidaê pojavljivanje u spektru gline prvog (niskofrekventnog) smoga - glavne smuge, ili glavne vrste. Idi 02; 03 itd. dati uvredljive samozadovoljne prizvuke.
Tromjesečni brojevi glavne smuge i prizvuka naznačeni su na isti način do (2.131) narednim rangom:
01 glavni smuga ili prizvuk,
0 1 = e - 2 e x e = e (1 - 2x e), (2.132)
02 1. prizvuk,
0 2 = 2 e - 6 e x e = 2 e (1 - 3x e), (2.133)
03 2. prizvuk,
0 3 = 3 e - 12 e x e = 3 e (1 - 4x e), (2.134)
Vypadku za prijelaz 0V":
0 V′ = V” e – V′(V′+1) e x e . (2,135)
Z otrimanih virazív vyplivaê, scho smugi poglanannya u kolivalnom spektru konvergiraju, želeći kroz one koji e x e<< e , эта сходимость для первых двух-трех полос выражена слабо. Величина e x e составляет обычно несколько см -1 , реже – десятки см -1 , в то время как e = 10 2 – 10 3 см -1 .
Imovirnist prijelaz 01 je najveći, niži i intenzitet glavnog smoga gline je objašnjen. Pokretljivost prijelaza 02; 03 itd., naglo se mijenjaju s porastom V", koji se pojavljuje u spektru gline.
Oznaka kolivalnog mjesta e taj koeficijent anharmoničnostix e .
Najvažniji rezultat eksperimentalnog usklađivanja IF spektara polja gline je kolivalna konstanta e i koeficijent anharmoniciteta x e .
donijeti smugs od gline na pjevanje kolyalny prijelaze.
dodijelite učestalost prijelaza kože kolivana: 1 , 2 , 3 .
postavite frekvencije kože jednake tipu (2.132) - (2.135) i, kršeći ih zajedno, dodijelite e i x e . Na primjer:
0 1 = e (1–2x e)
0 2 = 2 e (1–3x e).
Označena energija disocijacije (kemijska veza). Energija kemijske veze je ona energija koju je potrebno povećati da bi se molekula prenijela s nulte na maksimalnu kovalentnu kvantnu razinu:
Nagađanje jednako (2.127):
V max \u003d 1/2x e - 1/2.
Zamjenom vrijednosti (2.127) uzimamo:
E 0 Vmax = hc e (1/2x e - 1/2 + 1/2) - hc e x e (1/2x - 1/2 + 1/2) 2 , (2.136)
E 0 Vmax = hc e /2x e – hc e x e /4x e = hc e x e /4x, (2.137)
E max \u003d hc e / 4x e. (2,138)
Prijeđimo na molarne vrijednosti energije u J/mol:
E max (mol) \u003d E max N A, (2,139)
E max (mol) \u003d hc e N A / 4x e. (2.140)
Energija disocijacije, koja se energizira na nultoj razini i unosi do 1 mola, naziva se pravom energijom disocijacije i označava se s D o:
E x.s. = D o = E max - E 0. (2.141)
Kao rezultat toga, energija disocijacije je tjerana u krivulju minimalnog potencijala, ona će prevagnuti D 0 za vrijednost nulte energije (Sl. 2.18):
D e = D 0 + E 0. (2.142)
hc e N ALI
hc e

Pogodi što
E 0 \u003d 1/2 hc e - 1/4 hc e x e,
D 0 \u003d hc e / 4x e - (hc e / 2 - hc e x e / 4) , (2.143)
D 0 \u003d (1-x e) 2. (2.144)
Prelazeći na molarne vrijednosti, znamo vrijednost D 0 J/mol:
D 0 \u003d (1-x e) 2. (2,145)
Ovim redom: iz kolivalnog spektra mogu se uzeti sljedeće molekularne konstante:
Vlasnu frekvenciju koliva e;
Koeficijent anharmoničnosti heh;
Energija kolivalnog kretanja molekula;
Energija kemijske veze.
Elektronička polja (osnovni pojmovi). Kada su elektroni pobuđeni, molekule nastoje vibrirati u ultraljubičastom i vidljivom području spektra.
h \u003d E "" - E" \u003d (E "" vr - E" vr) + (E "" kobilica - E " kobilica) + (E" "jeo - E" jeo).
P  U bilo kojem trenutku vidjet će se slijed svih energetskih promjena. Spektar nabora naziva se elektronski-sudarni-overtall. Spektar se sastoji od samozadovoljne gline. Maksimalna linija gline vídpovídaê najveći mogući prijelaz u ovoj regiji do dovzhin hvil.
U bilo kojem trenutku vidjet će se slijed svih energetskih promjena. Spektar nabora naziva se elektronski-sudarni-overtall. Spektar se sastoji od samozadovoljne gline. Maksimalna linija gline vídpovídaê najveći mogući prijelaz u ovoj regiji do dovzhin hvil.
Slika 2.25 prikazuje širenje energetskih linija MO molekularnih orbitala ( i - vezni MO, * i * - širenje MO)
U glavnoj stanici - i -orbitale su zauzete elektronima (postoji veća stabilna energetska stanica s manjom potencijalnom energijom).
Najveća energija koja utječe na prijelaz * - pojavljuje se u dalekom UV području i utječe na molekule većine ugljikohidrata. Prijelazi * pokazuju vidljiva i blizu UV područja i tipove za molekule nepostojećih polja.

Riža. 2.26. Krivulje potencijalne energije izmjene tijekom elektroničkih prijelaza 
Gubitkom velikih kvantuma izmjenjive energije može doći do elektronskog skoka. Potencijalna energija disocijacije D0 se mijenja, a E raste. U trenutku porasta energije E, dolazi do porasta količine atomske energije r e kao rezultat mjehanja (slika 2.26).
Za dermalni izgled, veza je vlastita energija elektroničkih prijelaza i karakterizirana je samodopadnim glinenim mirisom s pjevnim dozhinoy dok.