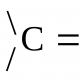Mélanger deux gaz à des températures différentes. Mélange de gaz. Fondamentaux de la thermodynamique chimique
13.7. Thermotransformateurs
Le plus souvent, au cours du processus technologique, il est nécessaire de maintenir la température.
La méthode la plus simple d'un tel support concerne le processus de combustion et le transfert de chaleur des produits de combustion chauds, soit directement, soit par transfert de chaleur intermédiaire. Dans ce cas, l'échange thermique est généré par la chaleur naturelle du noyau chaud due à la température. T 1 froid avec température T 2. Avec cette méthode, il est impossible de transférer plus de chaleur, qui n'est pas perdue par temps chaud (et le coût qui y est associé est bien moindre).
Cependant, il est en principe possible, compte tenu de la quantité de chaleur q" pour haute température T 1, sans gaspiller plus de chaleur à des températures plus basses T 2. Pour lequel il suffit de créer un cycle de Carnot direct inverse entre un coeur à haute température et un milieu à trop haute température T h, à la suite de quoi le robot recevra (div. (7.7)) :
Après avoir consacré ce travail au cycle de renouvellement de Carnot entre le milieu et la température T h Acceptons la température T 2, la quantité de chaleur comparable à la précédente est transférée au reste
Substituer le sens des robots dans cette expression je h Du premier point de vue, nous rejetons :

le facteur de proportionnalité ψ 1,2 est appelé coefficient de conversion thermique type de température T 1 jusqu'à la température T 2 .
Ozhe, après avoir décollé q" La quantité de chaleur d'un récipient avec la température T 1 peut être transmis au corps avec la température T 2 quantité de chaleur ψ 1,2 q" .
Alors comme ça T 2 T 1, alors je q" >q" .
Par exemple, allons t 1 = 1000 autour de Z, t 2 = 50 autour de Z, t h = 0 environ C. Coefficient. Ainsi, pour évacuer, disons, 5 J de chaleur à une température de 50°C, puis perdre 1 J de chaleur à 1000°C, tout comme dans l'installation de combustion d'origine 1 J de chaleur à haute température se transforme en même quantité de chaleur à basse température.
Aussi, du point de vue de la thermodynamique, l'installation de brûlage est 5 fois moins économique, et présente un chiffre d'affaires plus faible de l'installation de transfert de chaleur.
Un dispositif qui permet des cycles directs et inverses de transfert de chaleur d'un noyau à une température à une autre température est appelé thermotransformateur.
Si la température souhaitée est inférieure à celle du week-end, alors le thermotransformateur est appelé déclassement.
Pour maintenir une température élevée et une température plus basse, une assistance supplémentaire est nécessaire avances thermotransformateur, pour ceci ou cela T 2 > T 1 .
Riz. 13.7 Petit 13.8
Le thermotransformateur est relié au moteur thermique et à la pompe à chaleur.
En figue. La figure 13.7 montre un schéma d'un thermotransformateur abaisseur, et la figure. 13.8 – Cycle théorique Yogo.
En figue. 13.9 montre un schéma du thermotransformateur qui avance, et sur la Fig. 13h10 – Cycle théorique Yogo.
Sur les photos : I – moteur thermique, II – pompe à chaleur.
Si un thermotransformateur est utilisé pour maintenir des températures à la fois inférieures et supérieures, on l'appelle thermotransformateur de type mixte.
Riz. 13.9 Petit 13h10
Contrôler la nourriture
Comment fonctionne le cycle Carnot ?
Quel paramètre évalue le rendement thermodynamique d’une installation de pompe à chaleur ?
Quels sont les circuits importants des pompes à chaleur et des groupes frigorifiques ?
14. Mélange de gaz et de vapeurs
Dans divers appareils, il est souvent possible de mélanger divers gaz, vapeurs et liquides. Dans ce cas, vous devez spécifier les paramètres et définir les composants en fonction des paramètres donnés afin de créer cette somme.
La plus grande tâche incombe aux esprits derrière ce processus de mixage. Toutes les méthodes de création de folie peuvent être divisées en trois groupes :
mélange de gaz lors d'une communication constante,
mélange des flux gazeux,
mélange des gaz pendant l'heure de remplissage du réservoir.
14.1. Le processus de mélange dans une relation constante
Cette méthode de fabrication de la folie réside dans le fait qu'une petite quantité de gaz est utilisée dans un étau R. 1 , R. 2 , …, R. n, températures T 1 , T 2 , …, T n ta masami g 1 , g 2 , …, g n se livrer à l'abattage V 1 , V 2 , …, V n(Fig. 14.1).
Si vous installez des cloisons qui séparent les gaz, vous obtiendrez un mélange de gaz, ce qui donnera un mélange
V = V 1 + V 2 + …+ V n ,
et masa sumishi
g = g 1 + g 2 + …+ g n .
Lorsqu'ils sont réglés sur une valeur égale, les paramètres seront différents R., v, T, toi.
Puisque le processus est adiabatique et n'a pas changé, alors l'énergie interne du système est conservée jusqu'au premier élément de la thermodynamique :
U = U 1 +U 2 + …+ U n ou sinon Gu = G 1 toi 1 +G 2 toi 2 + … + g n toi n .
L'énergie interne de l'esprit est calculée comme suit :
![]() , (14.1)
, (14.1)
de g je- surface de masse je le gaz.
Et les animaux de compagnie doivent leurs devoirs à l'ancien
![]() . (14.2)
. (14.2)
Autres paramètres ( R., T) pour les gaz, vapeurs et liquides réels, voir les schémas de ces discours.
De plus, lorsque des gaz parfaits à capacité calorifique constante sont mélangés, pour lesquels du= c v dT, annulable
 Dans ce cas, si des portions d'un même gaz sont mélangées, la température du mélange est calculée par une formule plus simple :
Dans ce cas, si des portions d'un même gaz sont mélangées, la température du mélange est calculée par une formule plus simple :
![]() .
.
La pression sur le gaz après mélange est déterminée selon l'équation de Clayperon-Mendeleev
de R.- le gaz est devenu sumishi (indiqué dans la section 1.4).
14.2. Processus de mélange de flux
Dans ce type de mélange de gaz, le mélange de gaz résulte de la combinaison de plusieurs flux dans un seul canal.
Frappez le pipeline 1 (Fig. 14.2) le gaz avec les paramètres est fourni à la chambre de mélange p 1 , v 1 , T 1 , h 1, et par le pipeline 2 – gaz à partir des paramètres p 2 , v 2 , T 2 , h 2 .
Gaz Vitrat à travers le gazoduc 1 plus ancien g 1, à travers le pipeline 2 – g 2. A l'entrée de la chambre, les flux de gaz de mélange sont étranglés afin de créer une pression sur la chambre. R.était plus petit, plus bas R. 1 ta R. 2 (yakbi, par exemple, R. > R. 1, alors le gaz de la chambre de mélange se précipitera vers le pipeline 1 ).
Glisse pour parler, scho presse R. Dans la caméra, le mixage peut se faire différemment (réglages des vannes) ; Ici, le processus de mélange dans le processus est clairement différencié du mélange constant, et la pression est clairement déterminée par les paramètres des gaz mélangés.
Chambres de mélange de gaz avec paramètres R.,v, Têtre approvisionné par pipeline 3 . Consommation de gaz au gazoduc 3 , évidemment, plus ancien g = g 1 + g 2 .
Lorsque les fragments de gaz dans les pipelines s’effondrent, ils contiennent également (dans leur ensemble) de l’énergie cinétique et potentielle en plus de l’énergie interne. Par souci de simplicité (pour la plupart des tâches techniques, ce n'est pas vrai), il est important de rappeler que
les pipelines sont disposés horizontalement, ce qui permet d'obtenir le changement d'énergie potentielle ;
La fluidité du mouvement des gaz est donc très faible. Il est également possible de modifier l'énergie cinétique.
C'est donc possible avec le premier épi pour l'écoulement adiabatique (9.3) pour les esprits les plus brillants
Le produit est extrait du produit pour l'enthalpie distillée du mélange, extrait suite au mélange dans le pot :
![]() . (14.3)
. (14.3)
Connaître l'enthalpie h ce vice R. gaz après mélange, vous pouvez connaître d'autres paramètres du mélange dans le schéma supplémentaire ( T, v, s ta dans.).
Pour les gaz parfaits, remplacement de l'enthalpie d'alimentation par un virus h R. T, annulable
![]() . (14.4)
. (14.4)
Lorsque deux flux d’un même gaz sont mélangés, la formule de la température sera facile à comprendre :
![]() . (14.5)
. (14.5)
Je sais chanter la température T, En comparaison avec le gaz parfait, vous pouvez connaître la formule :
Les formules (14.3) à (14.5) peuvent être écrites de la même manière pour qu'un nombre suffisant de flux de gaz se mélangent.
14.3. Mélanger lors du remplissage
Allez au réservoir 1 (Fig. 14.3) obsyag Vє gaz (vapeur, liquide) en masse g 1 avec paramètres R. 1 , T 1 . Ce réservoir est équipé d'un pipeline 2 gaz à partir des paramètres R. 2 , v 2 , T 2 (évidemment R. 2 > R. 1) ta masoyu g 2 après quoi la vanne se ferme. Il y a beaucoup de gaz qui sort du réservoir V ta masoyu g = g 1 + g 2. Il est nécessaire de préciser les paramètres du montant récupéré.
Pendant le processus de remplissage, un robot doit passer au-dessus du gaz à proximité du pipeline 2 , Rivna – p 2 v 2 g 2 ; Il n'y a pas de travaux au réservoir, les restes du réservoir sont permanents.
Dans le processus adiabatique, le robot fonctionne grâce au changement d'énergie interne (comme auparavant l'énergie cinétique du gaz qui circule, inévitable compte tenu du manque de fluidité de l'écoulement) :
D'après l'énergie interne de l'animal, le vaisseau est ancien
![]()
Il y a beaucoup d'argent derrière le bon vieux temps v = V/ g.
Sciemment toiі v, à l'aide de diagrammes supplémentaires pour connaître d'autres paramètres de la somme ( R., T, s, h).
Lors du mélange d'un seul et même gaz parfait à capacités calorifiques constantes
de k- Indicateur d'adіabati.
La pression sur la cuve après mélange est nouvelle
Mélangez deux portions du mélange : le poids du premier composant est de 10 kg, la température est de 400 °C et le poids de l'autre composant est de 90 kg et la température est de 100 °C. Calculez la température du mélange. pour différentes méthodes de mélange.
Solution : la température du mélange résultant du processus de mélange sous pression constante ou du processus de mélange dans le flux de gaz est déterminée par la formule t = g 1 t 1 +g 2 t 2. Et dans notre pratique, c'est ancien t= 0,1 ∙ 400 + 0,9 ∙ 100 = 130 environ C.
Si vous réussissez à reconstituer le liquide, qui contient déjà le premier gaz, alors la température absolue est calculée à l'aide de la formule T = g 1 T 1 +kg 2 T 2. Ce mégot a un effet adhésif k= 1,4 et la température est encore plus chaude t= 0,1 (400 +273) +1,4 ∙ 0,9 ∙ (100 +273) - 273 = 264 autour de C.
14.4. Changement d'entropie pendant le mélange
L'entropie de la somme est donc la somme de l'entropie des sommes de l'entrepôt.
ou en tailles d'animaux de compagnie
Puisque le processus de mélange est un processus irrévocable, alors l'entropie du système thermodynamique (tout dans un discours adiabatiquement mélangé) est similaire à un autre élément de la thermodynamique dans le processus qui va alors croître.
Le caractère non renouvelable du processus de mélange s'explique par la diffusion des composants du mélange qui accompagne ce processus. L’augmentation de l’entropie dans le processus de mélange signifie que celui-ci est irréversible.
Contrôler la nourriture
Quelles sont les principales méthodes de mélange ?
De quelles manières le sumish est-il demandé ?
Comment déterminer la température d’un mélange en utilisant différentes méthodes de mélange ?
Comment expliquer qu’avec le mélange adiabatique des gaz et de la vapeur, l’entropie augmente ?
15. Fondements de la thermodynamique chimique
Un système hétérogène est défini par l’entrepôt de ses composants. Derrière les esprits chanteurs, l'entrepôt se trouvent les serpents pour les rahunoks du XIMICHY I FIZIKO-XIMICHICH, ils sont dans les systèmes, avec le YAKY VIDBUVA, Ruinvannya I viniknnya du nouveau Zv'yazkiva atomami. Ces processus s'accompagnent de la vision et de la reconstitution de l'énergie grâce aux forces de ces liens.
La thermodynamique chimique considère la condensation des premier et deuxième épis de la thermodynamique en substances chimiques et physico-chimiques.
15.1. Réactions chimiques
Khimichna rechovina– c’est donc un corps macroscopique de composition chimique. corps, bien qu'il ne soit pas clair de quels éléments chimiques il se compose et dans quelle proportion il est formé ( Substance chimique individuelle), et il est également clair quel type d'éléments chimiques il contient ( sumish ou sinon rozchin).
Une substance chimique est généralement caractérisée par une formule chimique qui indique de quels éléments elle est composée et dans quels atomes de ces éléments se réunissent pour sa création.
Les processus d'interaction entre des composés chimiques adjacents, qui conduisent à la création de nouveaux composés, sont appelés réactions chimiques.
Toute réaction chimique peut se produire dans des directions directes et inverses.
Dans les systèmes fermés, les réactions chimiques sont effectuées de telle manière que la quantité totale d’éléments chimiques cutanés présents dans le système ne change pas. Pour ces raisons, les réactions chimiques ne participent pas en beaucoup de mots, mais grandeurs stœchiométriques, alors. un certain nombre de substances qui correspondent aux formules chimiques des produits vocaux. Par conséquent, les réactions chimiques sont enregistrées comme comparaison entre les formules chimiques de la réaction et les formules chimiques des produits de cette réaction. Allons-y UN 1 , UN 2 , …, UN n- les discours du week-end, et DANS 1 , DANS 2 , …, DANS m- Les produits finaux de la réaction. Il s'agit d'une réaction chimique entre des substances UN 1 , UN 2 , …, UN n, qui appelait à l'achèvement des discours DANS 1 , DANS 2 , …, DANS m, inscrivez-vous avec vue sur le zèle :
en yakoma α 1, α 2, … α n, β 1 , β 2 … β m- Coefficients stœchiométriques. Par exemple, à la suite de la combustion du méthane, du dioxyde de carbone et de l'eau sont créés :
CH 4 + 2O 2 = CO 2 + 2H2O.
Un mot en chimie équivaut à 1 kilomètres Cette quantité contient un nombre très précis de molécules (atomes) d'un mot donné, semblable à l'ancien Avogadro. N UN= 6,02204∙10 23. Autrement dit : 1 mole de résine est définie comme la quantité de résine dont la masse en grammes est égale à sa masse moléculaire (atomique) M.
entrepôt de systèmes de pliage, créés à partir d'une grande variété de langues, la quantité de tissu cutané à devenir n je taupes, la chimie demande parties molaires composant du système.
1. Mélange de gaz à V=const. Comme le volume total occupé par les gaz avant et après mélange devient inchangé et que les gaz occupent des volumes V 1 , V 2 ,….. V n m 3 avant mélange, à pression p 1 , p 2 , p n et températures T 1 T n, et la relation entre les capacités calorifiques de ces gaz de r/s v augmente k 1, k 2,…. k n alors les paramètres sont calculés à l'aide des formules :
température
vice
 (5.15)
(5.15)
Pour des gaz ayant des capacités thermiques molaires égales, et donc des valeurs k égales, les formules (62) et (63) ressemblent à :
2. Mélange des flux gazeux. Quelle est la perte de masse des flux qui se mélangent, niveaux M 1, M 2, ... M n, kg/an, déchets volumétriques - V 1, V 2, ..... V n m 3 / an, volume de gaz - p 1, p 2, p n et températures - T 1, T 2, ... T n, et les valeurs des capacités calorifiques des gaz voisins dans la même région sont similaires à k 1, k 2, ... .k n, alors la somme des températures est calculée à l'aide de la formule :
 (5.18)
(5.18)
Le volume de déchets par heure à température T et pression :
 (5.19)
(5.19)
Pour les gaz qui ont k valeurs égales, la température du mélange est calculée à l'aide de la formule (64). Comme les flux de gaz, avec la même valeur de k, sont étroitement serrés, alors les formules (66) et (67) ressemblent à :
 (5.21)
(5.21)
Zavdannya
5.1. Trouvez le changement d'énergie interne de 1 kg de viande pendant la transition du moulin à oreilles t 1 = 300 0 C au moulin en bout à t 2 = 50 0 C. La dépendance de la capacité thermique sur la température est supposée être linéaire. Confirmation des dates en kJ.
Le changement d'énergie interne est trouvé à l'aide de la formule (5.9) :
Du = 3 vm (t 2 -t 1).
Table de concassage. 4.3, peut être retiré pour utilisation
(З vm) 0 t =0,7084+0,00009349t kJ/(kg K);
(Z vm) 50300 = 0,7084 +0,00009349 (50 +300) = 0,7411 kJ / (kg K).
Otje,
Du = 0,7411 (50-300) = - 185,3 kJ/kg
Version : DU = - 185,3 kJ/kg
5.2. Trouvez la variation de l'énergie interne de 2 m 3 d'air, si sa température diminue de t 1 = 250 0 C à t 2 = 70 0 C. La capacité thermique en fonction de la température est supposée être linéaire. Etau d'angle P1 = 0,6 MPa.
Version : DU = -1063 kJ.
5.3. 100 kJ de chaleur sont fournis au gaz, placé dans des cylindres à piston rotatif. La valeur de la sortie est de 115 kJ. Calculez la variation de l'énergie interne du gaz, puisque sa quantité est de 0,8 kg.
Version : DU = - 18,2 kJ.
5.4. 2 m 3 tours à une pression de 0,5 MPa et une température de 50 0 C seront mélangés avec 10 m 3 tours à une pression de 0,2 MPa et une température de 100 0 C. Calculez la pression et la température du mélange.
Exemple : t cm = 820C ; P cm = 0,25 MPa.
5.5. Les gaz de trois chaudières se mélangent dans les conduits de fumées combinés de la chaufferie, provoquant une circulation de la pression atmosphérique. Par souci de simplicité, tenons compte du fait que le gaz présent dans le nouvel entrepôt lui-même est : CO 2 =11,8% ; O2 = 6,8 % ; N2 = 75,6 % ; H2O=5,8%. La consommation de gaz devient V 1 =7100 m 3 /an ; V 2 = 2600 m3/an ; V 3 =11200 m 3 /an, et les températures des gaz sont similaires : t 1 =170 0 C, t 2 =220 0 C, t 3 =120 0 C. Calculer la température des gaz après mélange et leur volume circulant dans la cheminée à cette température.
Version : t = 147 0 ; V = 20 900 m 3 /an.
5.6. Les gaz qui s'écoulent de trois chaudières à vapeur à une pression de 0,1 MPa sont mélangés dans un conduit collecteur et rejetés dans l'atmosphère par un conduit de fumée. Un grand entrepôt de gaz qui part des prochaines chaudières de l'offensive : du premier
CO2 = 10,4% ; Pro2 = 7,2% ; N2 = 77,0 % ; H2O = 5,4 % ;
D'un autre
CO2 = 11,8 % ; O2 = 6,9 % ; N2 = 75,6 % ; H2O = 5,8 % ;
du troisième
CO2 = 12,0 % ; O2 = 4,1 % ; N2 = 77,8 % ; H2O=6,1%.
Les gaz résiduaires de Vartovi s'additionnent
M 1 = 12 000 kg/an ; M 2 = 6 500 kg/an ; M 3 = 8 400 kg/an ; et la température des gaz est évidemment t1 = 1300C ; t 2 = 1800C ; t 3 = 2000С.
Calculer la température des gaz après mélange dans le conduit de collecte. Supposons que les capacités calorifiques molaires de ces gaz sont les mêmes.
Version : t 2 = 164 0 Z.
5.7. Trois flux de gaz se mélangent au niveau du conduit de gaz, qui exerce une pression supérieure à 0,2 MPa. Le premier flux est de l'azote avec une perte volumétrique V 1 = 8 200 m 3 /an à une température de 200 0 C, l'autre flux est du dioxyde de carbone avec une perte volumétrique de 7 600 m 3 /an à une température de 500 0 C et le troisième flux - retour à la dépense de 6400 m 3 /an à une température de 800 0 C. Trouver la température des gaz après mélange et leur débit volumétrique au niveau du gazoduc.
Sujet : t 1 = 423 0 ; V=23000 m3/an.
5.8. Les produits de combustion du conduit de fumée de la chaudière à vapeur à raison de 400 kg/an à une température de 900 0 C sont refroidis à 500 0 C et envoyés directement à l'unité de séchage. Les gaz sont refroidis en mélangeant le flux de gaz avec le flux d'air à une température de 20 0 C. La pression dans les deux flux de gaz est la même. Calculez le taux de rendement annuel, car il est clair que R gaz = R surface. La capacité calorifique des produits de combustion sera égale à la capacité calorifique de l'air.
Version : M pov. = 366 kg/an.
Laissez-le reposer dans ces récipients thermostatés sous la même pression p je connais Gazi UNі DANS pris en petites quantités. Lorsque ces cuves seront connectées, il y aura un mélange rapide des gaz jusqu'à ce qu'un stockage de gaz homogène soit établi dans tout le système. On suppose que les gaz produits et leurs sommes sont du même ordre que les gaz parfaits. Todi pour économiser la pression constante des gaz p la pression partielle des gaz dans le sac à éliminer sera égale
Lors du mélange de gaz parfaits, des effets thermiques se produisent quotidiennement, l'échange thermique entre les gaz et le thermostat n'est pas observé et le changement de l'entropie du système est entièrement dû au caractère inévitable des processus au milieu du système.
Pour connaître le changement d'entropie, il est nécessaire de comparer le processus éphémère décrit avec une transition claire et égale entre les mêmes épis et fraises en bout du système.
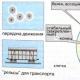
Pour un mélange égal de gaz, un dispositif hypothétique spécial, semblable à un thermostat, est appelé chimiostat. . Ce dispositif est constitué d'un cylindre thermostatique, déplacé sans frottement par un piston ; à la base du cylindre se trouve une membrane sélectivement perméable à une substance chimique individuelle donnée ; La parole individuelle reste renforcée, entraînée dans le chémostat, du mélange de parole qui semble être dans un autre vaisseau. En plus du thermostat, conçu pour maintenir la température de consigne d'un nouveau corps, et pour chauffer ou refroidir le corps restant dans le même mode, un chimiostat garantira le maintien de la valeur souhaitée du potentiel chimique. De ce discours individuel au suite à la folie des discours, et aussi il est tout aussi important de résumer et de séparer le discours de la folie. Potentiel chimique je - le composant homochimique d'un chimiostat est clairement indiqué par la température T et appuyez dessus avec un étau en le fermant sur les pistons. En modifiant la pression sur les pistons, il est possible de changer le sens de passage d'un composant donné à travers la membrane sélective : si le potentiel chimique du composant est dans le mélange final, alors lorsque le liquide est amené au mélange, lorsqu'on le retire du mélange, et entre le chimiostat et la folie, l'équilibre chimique est maintenu. Le changement quasi neutre dans la composition de l'esprit est mis en évidence par le transfert diffusionnel de la parole à travers la membrane sous l'influence même d'une petite différence dans la valeur du potentiel chimique du côté de la membrane.
Le potentiel chimique d'un gaz parfait, que ce gaz existe à l'état individuel ou en mélange avec d'autres gaz parfaits, s'exprime par des relations simples, p je Il y a soit une pression sur le gaz pur, soit une pression partielle sur la somme. Ainsi, lorsqu'un gaz parfait est transféré à travers une membrane perméable, l'égalité entre le réservoir et le chémostat est caractérisée par l'égalité de la pression dans le chimiostat et de la pression partielle du gaz dans le réservoir.

Riz. 2.3. Il est tout aussi important de mélanger les deux gaz à l’aide de chimiostats : un- Système de broyage en torchis ; b- Installation du système après détente isotherme des gaz ; V- Broyeur Kintsevy après mélange des gaz à travers des membranes ; 1 – chimiostase des gaz individuels A et B ; 2 – les membranes perméables ; 3 - Récipient pour un mélange égal des gaz.
Le mélange des gaz parfaits est tout aussi important UNі B effectué dans un système de thermostat, composé de deux chimiostats de composants individuels UNі B, relié au troisième vaisseau - la collecte de la somme, qui est créée, sécurisée, ainsi que la chimiostasie, avec un piston libre (Fig. 2.3).
Ne laissez pas les composants des chimiostats être présents au début du processus UN ta moles de composant B sous la même pression p
; Le piston du collecteur est en position zéro (le débit de gaz sous le piston est égal à zéro). Le processus de mélange s'effectue en deux étapes. Au premier stade, il y a une expansion isotherme inverse des gaz. UNі B; sous pression UN nous le réduisons p
à un vice et un vice donnés B certainement p
avant. Les activités liées aux gaz dans le premier et dans les autres chimiostats varient d'un type à l'autre. Le robot, vikonana à gaz, qui se dilate, dans le premier chimiostat, compare ![]() ; D'un autre
; D'un autre ![]() . Ainsi, dans un premier temps, une opération générale est réalisée dans notre dispositif hypothétique. En raison de la dilatation isotherme du gaz parfait, son énergie interne ne change pas et le robot fonctionne pour réduire l'apport de chaleur équivalent du thermostat. Le changement inverse de l'entropie dans le système sera égal à
. Ainsi, dans un premier temps, une opération générale est réalisée dans notre dispositif hypothétique. En raison de la dilatation isotherme du gaz parfait, son énergie interne ne change pas et le robot fonctionne pour réduire l'apport de chaleur équivalent du thermostat. Le changement inverse de l'entropie dans le système sera égal à
À une autre étape du processus (mélange de vapeur), les gaz provenant des chimiostats sont transférés automatiquement à travers des membranes sélectives dans le réservoir de mélange par le mouvement synchronisé de trois pistons. Lorsqu'une pression constante est appliquée sur la peau des pistons, il est probable que tant dans les chimiostats que dans le collecteur, ce qui assure une transition égale des gaz à travers les membranes (plus précisément, une pression est créée sur le collecteur moindre p , Préserver la force destructrice de la diffusion à travers les membranes à partir de zéro). L'efficacité du processus de mélange dans cette phase est assurée par la possibilité d'un changement synchrone du mouvement direct des trois pistons, ce qui entraînerait l'effet inverse sur les composants individuels. Une fois l’opération réalisée, vous emprunterez évidemment un volume au collectionneur.
Le mélange de fragments de gaz parfaits ne s'accompagne d'aucun effet thermique, l'échange thermique entre notre appareil et le thermostat à une autre étape de l'opération chaque jour. Cependant, il n’y a aucun changement dans l’entropie du système à ce stade.
Il est bon de croiser le chemin du pidrahunku direct, pour que le travail des gaz à une autre étape soit égal à zéro. Il est vrai que le travail est consacré au déplacement des pistons dans les chimiostats, et en même temps le collecteur de gaz est réalisé en fonction de la taille du robot. Zvidsi.
De plus, l'augmentation totale de l'entropie lors du mélange des gaz est donnée par l'expression (2.9), . Cependant, à mixage tout aussi important, cette augmentation des liants est due à la restitution de l'apport thermique et à l'augmentation de la puissance équivalente du travail. ![]() , puis avec un mélange direct (irréversible) de gaz, la même augmentation d'entropie est due au taux de génération au milieu du système ; Il n’y a aucun moyen d’interférer avec un système robotique.
, puis avec un mélange direct (irréversible) de gaz, la même augmentation d'entropie est due au taux de génération au milieu du système ; Il n’y a aucun moyen d’interférer avec un système robotique.
Après la substitution (2.8), l'expression (2.9) peut être réécrite sous la forme
 . (2.10)
. (2.10)
Cela est dû à la place obligatoire dans les cours de thermodynamique à travers ses paradoxes. Il est à noter que le changement d'entropie (lorsque des gaz parfaits sont mélangés !) n'a aucune signification, car il est affecté par le mélange et l'influence sous certaines pressions et températures. En fait, un point informel a été soulevé ici (2.10).
Illustration supplémentaire (2.10) avec héritages bruns. Présentation des parties molaires des composants ![]() Et nous supprimons l'expression pour modifier l'entropie en augmentant la quantité pour 1 mole de somme, ce qui crée :
Et nous supprimons l'expression pour modifier l'entropie en augmentant la quantité pour 1 mole de somme, ce qui crée :
![]() . (2.11)
. (2.11)
La valeur maximale de cette fonction est la quantité équimolaire de gaz, 0,5.
Selon la théorie, sous couvert de discours, il est nécessaire de procéder à un changement de génération d'entropie lors de l'ajout d'un grand nombre de moles du composant B jusqu'à un composant UN. Respectueusement dans (2.10) et , nous rejetons
Lors de la dérivation (2.12), une représentation mathématique de la fonction logarithmique a été utilisée
 .
.
La formule (2.12) montre que les dilutions successives s'accompagnent d'augmentations infinies d'entropie dues à l'augmentation par mole du composant d'origine.
La formule (2.10) donne la valeur intégrale de l'augmentation de l'entropie lorsque les quantités de gaz final sont mélangées. Afin d'arriver à une expression différentielle compacte, similaire à la formule (2.7) pour le transfert de chaleur, nous modifions le modèle de mélange de composants (div. Fig. 2.4). On suppose que le mélange est aspiré à travers une membrane perméable aux deux composants, ou à travers une vanne étroite qui sépare les récipients remplis de mélanges. UNі B divers entrepôts. Le système est contrôlé par thermostat et, dans les deux réservoirs, une pression constante est appliquée aux deux pistons. p . Lors des échanges de fluidité, le mélange du stockage du sumisha dans la peau des récipients peut être pris en compte en même temps que l'obligation du juge. Ainsi, ce système s'apparente à un système d'échange thermique avec une cloison à faible conductivité.
Arrêter de rire n chimiquement non réactif entre eux idéal gaz. Il est transféré en fonction des paramètres thermodynamiques grossiers de tous les composants jusqu'au mélange et au lavage (réaction avec le milieu en excès). Dois savoir d'importance égale paramètres de production de gaz après mélange
Voyons deux types de mixage, par souci de simplicité, en tenant compte de ce qu'implique ce processus sans échange thermique avec excès de liquide .
2.1. Mélange à W=Const
Dont le type d'esprit est tellement mélangé qu'il en devient fou, qu'il s'installe W voir les anciennes sommes des composants en épi du sumisha W H je :
(Ne te perds pas W H je avec obligations partielles Wi, voir paragraphe 1.4.3.)
Significativement:
P H je- Etau en torchis je-ème gaz;
T H je,t Salut je- Température Pochatkova je-le gaz est fourni à 0 Avant ou 0 Z.
Parce que tout le système n gaz lorsqu'ils sont mélangés dans les égouts W=Const S'il n'y a pas de robots externes, alors on peut écrire au premier épi de la thermodynamique pour lequel () on peut écrire :
Ici: U cm - l'énergie interne mélange les gaz avec la masse m cm kilogrammes
avec température T0K;
U H je- énergie interne je-ième masse de gaz je suis kilogrammes
avec température de l'épi T H je .
Saisissez la désignation :
toi cm - alimenter l'énergie interne et mélanger les gaz à température normale T0K;
u Salut je - alimentation énergie interne je-ième gaz avec température de l'épi T H je .
Alors l’équation (2.1.1) ressemble à ceci :
(2.1.2)
Apparemment, pour un gaz parfait du = C v dT Signes de libération d'énergie interne 0 0 Avant tu peux écrire:
Ici : - Milieu de gamme 0 T0K capacité calorifique isochore massique d’un mélange de gaz ;
Milieu de gamme 0 T H i 0 K capacité thermique isochore de masse je le gaz.
Après substitution (2.1.3) (2.1.2), ce qui suit est supprimé :
Conformément au paragraphe 1.4.10, la capacité calorifique massique de référence d'un mélange de gaz est exprimée à travers les fractions massiques des composants g je et leurs capacités thermiques respectives à ce jour :
Similaire au milieu de gamme 0 T0K La capacité calorifique isochore massique d’un mélange de gaz est calculée comme suit :
En substituant cette expression, la partie gauche de l'équation (2.1.4) est omise :
étoiles (2.1.5)
Parce que Je deviendrai jaloux, puis après substitution je suis jusqu'à ce que l'équation (2.1.5), la formule pour la température de la pièce soit supprimée de manière résiduelle n Gaziv :
Apparemment, la formule (2.1.6) peut s'écrire sous la forme suivante :
(Devinez que le solide est au milieu dans la plage 0- T H i 0 Kmolaire Capacité thermique isochore je le gaz.)
Dans la littérature prémoderne, des plages empiriques de capacité thermique en fonction de la température sont souvent données pour une plage 0 t 0 C .
Après substitution (2.1.8) et (2.1.9) à l'égalisation (2.1.2), ce qui suit est supprimé :
Remplacer je suis Pour cette valeur, la formule de la température du mélange de gaz en degrés est supprimée. Celsius :
Vislovlyyuchi R je En utilisant le poids moléculaire, nous pouvons dériver une autre formule :
Les signifiants des formules (2.1.6), (2.1.7), (2.1.10) et (2.1.11) ont des capacités thermiques moyennes, dans lesquelles la limite supérieure est la température moyenne ( t ou sinon T), ce qui étend le sens. De ce fait, la température de la somme est indiquée par ces formules méthode de proximité successive .
2.1.1. Types privés de mélange de gaz avec W=Const
Jetons un coup d'œil à un certain nombre de défauts des formules (2.1.6), (2.1.7), (2.1.10) et (2.1.11).
1. Arrêtez de mélanger des gaz qui montrent de l'adiabati. Jusqu'à ce que je La température peut être déterminée.
(En vérité Avant change avec l’augmentation de la température, etc.
de déchets , UN- Coefficients positifs impériaux.
Pour les échelles techniques comprises entre 0 et 2000, 0 C peut être calculé à l'aide des formules suivantes :
a) pour les gaz diatomiques Avant 1,40 - 0,50 10 -4 t;
b) pour les produits de combustion Avant 1,35 - 0,55 10 -4 t.
De ces formules, il ressort clairement que l'afflux de température sur l'indicateur adiabatique Avant Cela ne devient perceptible qu'à des températures proches de plusieurs centaines de degrés au-dessus de l'échelle Celsius.
Donc, si tu laisses tomber, alors
alors la formule (2.1.6) apparaît immédiatement :
La formule (2.1.12) peut être utilisée en première approximation pour les formules (2.1.6), (2.1.7), (2.1.10) et (2.1.11)
2. Ne pas mélanger des gaz dont les capacités calorifiques isochores sont égales et la localisation de ces capacités calorifiques en fonction de la température peut être obtenue, de sorte que :
Cette jalousie (2.1.7) apparaît même d’un seul coup d’œil :
Puisque les gaz ont des capacités thermiques isochoriques molaires égales, cela est cohérent avec l’équation de Mayer
Ils doivent être égaux les uns aux autres et avoir des capacités thermiques plus petites et, par conséquent, des indicateurs d'adibatilité égaux.
Dans ce cas, l'équation (2.1.12) se transforme en (2.1.13).
2.1.2. Pression après mélange des gaz avec W=Const
La pression qui s'installe après le mélange des gaz peut être calculée soit à l'aide des formules du paragraphe 1.4.2, soit à l'aide des éléments suivants :
R. cm W cm = m cm R. cm T= m cm T.
Il y a trois boules horizontales A, B et C de notre station-service, et la boule d'expansion est plus grande que A, et A est plus grande que C. Il est désormais possible de retirer n'importe quelle somme d'argent de l'entrepôt A en mélangeant un certain volume de la balle Z avec le volume de la balle B. En arrière, s'il y a une grande somme d'argent dans l'entrepôt, A peut être divisé en deux sacs, un dans l'entrepôt et un dans C.
Ce mélange des deux gaz peut se faire par un trajet inverse, situé dans les canalisations horizontales A, B et C. L'extrémité du tuyau skin qui sort du tuyau de gaz est fermée par un piston. Plaçons maintenant les pistons au milieu des billes B et C, en les effondrant, disons, de droite à gauche, et au point A, cependant, le piston pend de droite à gauche. Ensuite, en entrant et en sortant de deux gaz, il y aura un mélange, et A, enfin, vous trouverez un moyen de vous en débarrasser. Nous acceptons que dans un tel tuyau se trouve une masse déca du même récipient que la boule horizontale de flux de gaz à laquelle ce tuyau est connecté.
![]()
Les significations sont également déterminées à partir des rangs
Voici ce qui suit :
![]()
Nous sommes désormais partagés entre ce genre de chemin de loup-garou et notre travail perdu.
Nous introduisons dans A one l'obligation de sumisha, et de i nous voyons, évidemment, l'obligation
Tout le travail gaspillé dans ce processus est ancien
En substituant ici des valeurs, il est clair que ce travail est égal à zéro.
Il y a ici une subtilité : les sommes sur lesquelles la somme A s'est divisée, ont été élevées à des hauteurs différentes et ont ainsi ajouté différentes énergies potentielles. Si le robot est en dessous de zéro et que la température du système est constante, cela n'est possible que parce que le système a cédé ou perdu beaucoup de chaleur. Connaissant le changement d’énergie potentielle, nous connaissons la quantité de chaleur transférée au système, et donc le changement d’entropie.
Augmentation du potentiel de stockage d’énergie
Cependant, il y aura une augmentation de la quantité de chaleur transférée au système, de sorte que l'augmentation de l'entropie sera d'un
Pour une telle valeur de la somme des entropies, la somme totale et la somme des sommes Avec plus d'une entropie, la somme de A. De là, vous pouvez trouver la somme des sommes B et C, la somme des entropies de qui sont les mêmes.shi A; pour lequel nous amènerons les obligations des sommes dans et avec le chemin isotherme inverse à l'obligation et le montant de l'augmentation de l'entropie des deux sommes dans ce processus est égal au virus (75) extrait du clignotant.
Incrément d'entropie pour un grand entrepôt
![]()
![]()
Convient pour une utilisation dans une ligne (76) pour étaux traversant l'épaisseur