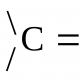வெவ்வேறு வெப்பநிலையுடன் இரண்டு வாயுக்களை கலத்தல். Zmіshuvannya gazіv. வேதியியல் வெப்ப இயக்கவியலின் அடிப்படைகள்
13.7. வெப்ப மின்மாற்றிகள்
பெரும்பாலான தொழில்நுட்ப செயல்முறைகளில், அதே வெப்பநிலையை வைத்திருப்பது அவசியம்.
இந்த வகையான குளிர்ச்சியின் எளிய வழி, நெருப்பை எரிப்பது மற்றும் சூடான எரிப்பு பொருட்களிலிருந்து வெப்பத்தை மாற்றுவது அல்லது நடுத்தர வெப்பம் அல்லது இடைநிலை வெப்பம் இல்லாமல். என்ன வெப்ப பரிமாற்றம் ஒரு வெப்பநிலையுடன் ஒரு சூடான dzherel திசையில் ஒரு இயற்கை பாதை மூலம் மேற்கொள்ளப்படுகிறது டிவெப்பநிலையுடன் 1 குளிர் டி 2. இந்த முறையால், அதிக வெப்பம் உள்ளது, தீ எரியும் போது குறைந்த ஓட்ரிமேன், அதை மாற்ற இயலாது (மற்றும் செலவுடன் இணைப்பு மிகவும் குறைவாக உள்ளது).
எனினும், கொள்கையளவில் அது சாத்தியம், deak நிறைய வெப்பம் தறியும் கே" அதிக வெப்பநிலைக்கு டி 1, வேலையைப் பயன்படுத்தாமல் குறைந்த வெப்பநிலையில் அதிக வெப்பத்தை எடுக்கவும் டி 2. அதிக வெப்பநிலை மற்றும் உயர் வெப்பநிலை ஊடகம் இடையே ஒரு தலைகீழ் நேரடி கார்னோட் சுழற்சியை உருவாக்க இது போதுமானது டி ம, இதன் விளைவாக ரோபோவுக்கு எடுத்துச் செல்லப்படும் (டிவ். (7.7)):
விட்ரடிவ்ஷி டியூ வெப்பநிலை T உடன் நடுத்தரத்திற்கு இடையில் தலைகீழ் தலைகீழ் சுழற்சி கார்னோட்டில் வேலை செய்கிறது மமற்றும் வெப்பநிலையுடன் அமைதியாக இருக்கும் டி 2, ஆரோக்கியமான வெப்பத்தின் அளவை மற்றவர்களுக்கு மாற்றுவோம்
இந்த சூழலில் ரோபோட்களின் அர்த்தத்தை மாற்றுவது எல் மமுன் விராசுவிலிருந்து, நாங்கள் எடுத்துக்கொள்கிறோம்:

விகிதாச்சாரத்தின் குணகம் ψ 1.2 என அழைக்கப்படுகிறது வெப்ப மாற்று குணகம்வெப்பநிலை படி டி 1 வெப்பநிலை வரை டி 2 .
Otzhe, otrimavshi கே" வெப்பநிலையுடன் dzherel வெப்பத்தின் அளவு டி 1 வெப்பநிலையுடன் உடலுக்குப் பரவுகிறது டி 2 அளவு வெப்பம் ψ 1.2 கே" .
அதனால் யாக் டி 2 டி 1 , பின்னர் ஐ கே" >கே" .
உதாரணமாக, நாம் டி 1 = 1000 pro Z, டி 2 = 50 pro Z, டி ம = 0 பற்றி C. குணகம். இந்த வழியில், எடுத்துக்காட்டாக, 50 C வெப்பநிலையில் 5 J வெப்பத்தை எடுக்க, அது 1000 C இல் 1 J க்கும் குறைவான வெப்பமாக இருக்க வேண்டும், அதே சமயம் ஒரு ஆரம்ப எரியும் நிறுவலின் போது 1 J அதிக வெப்பநிலையில் உள்ள வெப்பம் குறைந்த வெப்பநிலையில் அத்தகைய அளவு வெப்பமாக செல்ல வேண்டும்.
மேலும், வெப்ப இயக்கவியலின் ஒரு பார்வையுடன், ஓபல் நிறுவல் 5 மடங்கு குறைவான சிக்கனமானது, குறைந்த தலைகீழ் வெப்ப-பரிமாற்ற நிறுவல் ஆகும்.
இணைப்பு, அதே வெப்பநிலையுடன் குறைந்த வெப்பநிலைக்கு டிஜெரலில் இருந்து வெப்ப பரிமாற்றத்தின் நேரடி மற்றும் தலைகீழ் சுழற்சிகளை அனுமதிக்கிறது, இது அழைக்கப்படுகிறது தெர்மோட்ரான்ஸ்ஃபார்மர்.
வார இறுதியில் வெப்பநிலை குறைவாக இருந்தால், தெர்மோட்ரான்ஸ்ஃபார்மர் அழைக்கப்படுகிறது குறைக்கிறது.
அதிக வெப்பநிலை, குறைந்த காற்றைக் குறைக்க, கூடுதல் உதவி தேவை நகர்வுதெர்மோட்ரான்ஸ்ஃபார்மர், சிலருக்கு, அதனால் யாக் டி 2 > டி 1 .
அரிசி. 13.7 சிறியது 13.8
வெப்ப இயந்திரம் மற்றும் வெப்ப பம்ப் ஆகியவற்றிற்கான தெர்மோட்ரான்ஸ்ஃபார்மர்.
அத்திப்பழத்தில். 13.7 ஒரு படி-கீழ் வெப்ப மின்மாற்றியின் வரைபடத்தைக் காட்டுகிறது, மேலும் அத்தி. 13.8 - யோகோ தத்துவார்த்த சுழற்சி.
அத்திப்பழத்தில். 13.9 நகரும் தெர்மோட்ரான்ஸ்ஃபார்மரின் வரைபடத்தைக் காட்டுகிறது, மேலும் அத்தி. 13.10 - யோகா தத்துவார்த்த சுழற்சி.
புள்ளிவிவரங்களில்: І - வெப்ப இயந்திரம், ІІ - வெப்ப பம்ப்.
வெப்பநிலையை குறைவாக, і அதிக, குறைந்த வெளியீடு, வின் என அழைக்கப்படுகிறது. கலப்பு வகை தெர்மோட்ரான்ஸ்ஃபார்மர்.
அரிசி. 13.9 சிறியது. 13.10
ஊட்டச்சத்தை கட்டுப்படுத்தவும்
கார்னோட்டின் தலைகீழ் சுழற்சி எவ்வாறு செயல்படுகிறது?
வெப்ப விசையியக்கக் குழாய் நிறுவலின் வெப்ப இயக்கவியல் செயல்திறனை எந்த அளவுரு மதிப்பிடுகிறது?
வெப்ப பம்ப் மற்றும் குளிர்பதன அலகுகளின் முக்கியமான திட்டங்கள் யாவை?
14. வாயு மற்றும் நீராவி மாற்றம்
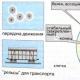
பல்வேறு outbuildings மணிக்கு, தாய்மார்கள் அடிக்கடி பல்வேறு வாயுக்கள், நீராவி மற்றும் காற்று zmіshuvannyam மூலம் வலது கொண்டு. இதில் அளவுருக்களைக் குறிப்பிடுவது அவசியமானால், கொடுக்கப்பட்ட அளவுருக்களுக்கான கூட்டுத்தொகையாக நான் மாறுவேன், நான் கூறுகளாக மாறுவேன், இது கூட்டுத்தொகையைத் தீர்மானிக்கும்.
இந்தப் பணியின் நிறைவேற்றம், இந்த மாற்றத்தின் செயல்முறை உருவாக்கப்பட்ட மனங்களில் உள்ளது. தொகையை உருவாக்கும் அனைத்து வழிகளையும் மூன்று குழுக்களாக பிரிக்கலாம்:
zmіshuvannya gazіv நிலையான obsyazі,
வாயு ஓட்டங்களின் கலவை,
zmіshuvannya gazіv pіd மணி zapovnennya தொட்டி.
14.1. பதவியை மாற்றும் செயல்முறை
வைஸில் இருந்து வாயு தெளிக்கப்படுவதால், தொகைகளின் கூட்டுத்தொகையை உருவாக்குவதற்கான வழி என்ன? ஆர் 1 , ஆர் 2 , …, ஆர் n, வெப்பநிலை டி 1 , டி 2 , …, டி nதா மாசாமி ஜி 1 , ஜி 2 , …, ஜி nவெவ்வேறு கடமைகளை கடன் வாங்குங்கள் வி 1 , வி 2 , …, வி n(படம் 14.1).
வாயுக்களுக்கு இடையில் பரவும் பகிர்வுகளை நீங்கள் ஒழுங்கமைத்தால், வாயுக்களின் கலவை இருக்கும்.
வி = வி 1 + வி 2 + …+ வி n ,
மற்றும் நிறைய பைத்தியம்
ஜி = ஜி 1 + ஜி 2 + …+ ஜி n .
சமமான முக்கியமான ஒன்றை நிறுவுவதன் மூலம், தொகையின் அளவுருக்கள் இருக்கும் ஆர், v, டி, u.
அடியாபாடிக் செயல்முறை மாறவில்லை என்றால், அமைப்பின் உள் ஆற்றல் வெப்ப இயக்கவியலின் முதல் கோப்பில் சேமிக்கப்படுகிறது:
U = U 1 + யு 2 +…+ யு nஅல்லது கு=ஜி 1 u 1 + ஜி 2 u 2 + … + ஜி n u n .
செல்லப்பிராணியின் உள் ஆற்றல் பின்வருமாறு அளவிடப்படுகிறது:
![]() , (14.1)
, (14.1)
de g நான்- நிறை பின்னம் நான்வது வாயு.
மற்றும் செல்லம் அவரது நியமனத்திற்கு ஒப்புக்கொண்டது
![]() . (14.2)
. (14.2)
மற்ற அளவுருக்கள் ( ஆர், டி) உண்மையான வாயுக்களுக்கு, parіv மற்றும் rіdin ஆகியவை இந்த உரைகளுக்கான வரைபடங்களில் காணப்படுகின்றன.
குளிர்ச்சியான மனநிலையில், நிலையான வெப்பத் திறன் கொண்ட சிறந்த வாயுக்கள் கலந்திருந்தால், அவற்றிற்கு du= c v டிடி, எடுக்கப்பட்டது
 அப்படியானால், அதே வாயுவின் பகுதிகள் ஏற்ற இறக்கமாக இருந்தால், தொகையின் வெப்பநிலை மிகவும் எளிமையான சூத்திரத்தைப் பயன்படுத்தி கணக்கிடப்படுகிறது:
அப்படியானால், அதே வாயுவின் பகுதிகள் ஏற்ற இறக்கமாக இருந்தால், தொகையின் வெப்பநிலை மிகவும் எளிமையான சூத்திரத்தைப் பயன்படுத்தி கணக்கிடப்படுகிறது:
![]() .
.
மாற்றத்திற்குப் பிறகு வாயு அழுத்தம் கிளாபெரோன்-மெண்டலீவ்க்கு சமமானதாகக் கணக்கிடப்படுகிறது
de ஆர்- வாயு சுமிஷி ஆனது (பிரிவு 1.4 இல் நியமிக்கப்பட்டது).
14.2. நீரோடைகளை கலக்கும் செயல்முறை
இந்த வழியில், ஒரு சேனலில் பல ஓட்டங்கள் குவிந்ததன் விளைவாக வாயுக்களின் ஏற்ற இறக்கம் ஏற்படுகிறது.
பைப்லைனை விடுங்கள் 1 (படம் 14.2) அளவுருக்கள் கொண்ட வாயு கலவை அறைக்கு வழங்கப்பட வேண்டும் ப 1 , v 1 , டி 1 , ம 1 , மற்றும் குழாய் வழியாக 2 - அளவுருக்கள் கொண்ட வாயு ப 2 , v 2 , டி 2 , ம 2 .
குழாய் வழியாக விட்ராடா வாயு 1 dorivnyuє ஜி 1, குழாய் வழியாக 2 – ஜி 2. அறையின் நுழைவாயிலில், அறையை அழுத்துவதற்காக கலவை மற்றும் வாயு பாய்ச்சல்கள் தூண்டப்படுகின்றன. ஆர் bulo குறைவாக, குறைந்த ஆர் 1 டா ஆர் 2 (யாக்பி, எடுத்துக்காட்டாக, ஆர் > ஆர் 1, பின்னர் அறையிலிருந்து வாயு குழாய்க்கு விரைந்து செல்லும் 1 ).
அடுத்த குரல், என்ன ஒரு துணை ஆர்அறையில், காற்றோட்டம் வித்தியாசமாக சரிசெய்யப்படலாம் (வால்வுகளை சரிசெய்தல்); மின்னோட்டத்தில் ஏற்ற இறக்கங்களின் செயல்முறையானது நிலையான நிலையில் உள்ள ஏற்ற இறக்கங்களைப் போலவே உள்ளது, டி டிஸ்க் என்பது ஏற்ற இறக்கமான வாயுக்களின் அளவுருக்களால் தனித்துவமாக வகைப்படுத்தப்படுகிறது.
அளவுருக்கள் கொண்ட வாயுவை கலக்கும் அறைகளிலிருந்து ஆர்,v, டிகுழாய் 3 . பைப்லைனில் விட்ரடா வாயு 3 , வெளிப்படையாக, dorivnyuє ஜி = ஜி 1 + ஜி 2 .
குழாய்களில் சிதறிய வாயு சரிகிறது, பின்னர், krіm vnutrishnyoї energії, vіn maє (yak tіle) sche மற்றும் இயக்கவியல் மற்றும் ஆற்றல் ஆற்றல். எளிமைக்காக (அதிக தொழில்நுட்ப சிக்கல்களுக்கு, இது உண்மைதான்), அது முக்கியம்
கிடைமட்டமாக roztashovan குழாய்கள், zm_noy திறன் ஆற்றல் znehtuvat இருக்க முடியும்;
நகரும் வாயுவின் வேகம் சிறியதாக இருக்க வேண்டும். மாறும் இயக்க ஆற்றல் கூட nechtuyemo உள்ளது.
அடியாபாடிக் ஓட்டத்திற்கான முதல் கோப்புடன் அதே விஷயம் (9.3)
Zvіdsi otrimaєmo viraz for pet enthalpії sumіshi, வியர்வையில் zmіshuvannya விளைவாக otrimana:
![]() . (14.3)
. (14.3)
உங்கள் செல்லப்பிராணியின் என்டல்பியை அறிவது மஎன்று வைஸ் ஆர்வாயுவை மாற்றிய பிறகு, கூடுதல் வரைபடங்களுக்கு நான் தொகையின் மற்ற அளவுருக்களை அறிய முடியும் ( டி, v, கள்மற்றும் உள்ளே.).
சிறந்த வாயுக்களுக்கு, இந்த என்டல்பியை விராஸுடன் மாற்றவும் ம ஆர் டி, எடுக்கப்பட்டது
![]() . (14.4)
. (14.4)
ஒரு வாயுவின் இரண்டு ஓட்டங்களைக் கலக்கும் நேரத்தில், தொகையின் வெப்பநிலைக்கான சூத்திரம் எளிமையாக இருக்கும்:
![]() . (14.5)
. (14.5)
அத்தகைய தரவரிசையில் வெப்பநிலையை அறிவது டி, நான் இலட்சிய வாயுவுக்குச் சமமாகிவிடுவேன், நீங்கள் குட்டி ஒப்ஸ்யாக்கை அறியலாம்:
சூத்திரங்கள் (14.3)–(14.5) ஏற்ற இறக்கத்துடன் இருக்கும் குறிப்பிட்ட எண்ணிக்கையிலான வாயு ஓட்டங்களுக்கு இதே வழியில் எழுதப்படுகின்றன.
14.3. கடமை நேரத்தில் நினைவு
தொட்டிக்குச் செல்லுங்கள் 1 (படம் 14.3) விவாயு (நீராவி, தாய்நாடு) ஜிஅளவுருக்கள் கொண்ட 1 ஆர் 1 , டிஒன்று . யாருடைய தொட்டியில் குழாய் உள்ளது 2 எரிவாயு iz அளவுருக்கள் ஆர் 2 , v 2 , டி 2 (வெளிப்படையாக, என்ன ஆர் 2 > ஆர் 1) நிறை மூலம் ஜி 2 அதன் பிறகு வால்வு மூடுகிறது. நீர்த்தேக்கத்தில், ஒரு தொகை வாயு முழுமையாக வெளியேறுகிறது விஎன்று மசோயு ஜி = ஜி 1 + ஜி 2. எடுக்கப்பட்ட தொகையின் அளவுருக்களைக் குறிப்பிடுவது அவசியம்.
நிரப்பும் செயல்பாட்டில், குழாயில் எரிவாயு மீது ஒரு ரோபோ நிறுவப்படுகிறது 2 , ரிவ்னா – ப 2 v 2 ஜி 2; நீர்த்தேக்கத்தில் ரோபோ இல்லை, துண்டுகள் நீர்த்தேக்கத்தில் சரி செய்யப்பட்டுள்ளன.
ரோபோவின் அடியாபாடிக் செயல்பாட்டில், சமநிலைக்கான உள் ஆற்றலை மாற்றுவது அவசியம் (முன்பு, பாயும் வாயுவின் இயக்க ஆற்றல், ஓட்டத்தின் திரவத்தன்மையின் பற்றாக்குறையைப் பார்க்க முடியாது):
கப்பலில் Zvіdsi செல்லப்பிராணியின் உள் ஆற்றல் சுமிஷ் ஆரோக்கியமானது
![]()
பணத்திற்காக நிறைய தொகைகளை பிடோமா v = வி/ ஜி.
தெரிந்து கொள்வது uі v, கூடுதல் வரைபடங்களுக்கு, மற்ற அளவுருக்கள் சுமிஷி ( ஆர், டி, கள், ம).
நிலையான வெப்பத் திறன் கொண்ட ஒரே சிறந்த வாயுவைக் கலக்கும் நேரத்தில்
de கே- அடியாபதியின் காட்டி.
தொட்டியில் துணை
இரண்டு பகுதிகள் ஒரு வரிசையில் கலக்கப்படுகின்றன, மேலும், முதல் கூறுகளின் எடை 10 கிலோ, வெப்பநிலை 400 ° C, மற்றும் மற்ற கூறுகளின் நிறை 90 கிலோ, மற்றும் வெப்பநிலை 100 ° C ஆகும்.
தீர்வு: நிரந்தர காற்றோட்டம் அல்லது வாயு ஓட்டத்தில் ஏற்ற இறக்கம் செயல்முறையின் ஏற்ற இறக்க செயல்முறையின் விளைவாக மொத்த வெப்பநிலை சூத்திரத்தைப் பொறுத்தது டி = g 1 டி 1 +g 2 டி 2. எங்கள் பயன்பாட்டில் நான் மிகவும் விலை உயர்ந்தது டி\u003d 0.1 ∙ 400 + 0.9 ∙ 100 \u003d 130 ப்ரோ சி.
முதல் வாயு ஏற்கனவே அறியப்பட்ட அர்ப்பணிப்பின் விளைவாக இது சுருக்கமாக இருந்தால், முழுமையான வெப்பநிலை சூத்திரத்தின்படி கணக்கிடப்படுகிறது. டி = g 1 டி 1 +கிலோ 2 டி 2. இந்த பட் மீண்டும் அடியாபதியின் காட்சியைக் கொண்டுள்ளது கே= 1.4 டி\u003d 0.1 (400 +273) +1.4 ∙ 0.9 ∙ (100 +273) - 273 \u003d 264 சுமார் சி.
14.4. மாறும்போது என்ட்ரோபியை மாற்றுதல்
சுமிஷின் என்ட்ரோபி என்பது கியூ சுமிஷ், டோப்டோ என்ற கிடங்கு என்ட்ரோபியின் கூட்டுத்தொகை ஆகும்.
ஆனால் செல்லப்பிராணி அளவுகளில்
மாற்றத்தின் செயல்முறை மீளமுடியாத செயல்முறையாக இருப்பதால், வெப்ப இயக்கவியல் அமைப்பின் என்ட்ரோபி (பேச்சுக்கு அடிபணிய மாற்றத்தில் உள்ள அனைத்தும்) செயல்பாட்டில் உள்ள வெப்ப இயக்கவியலின் மற்றொரு கோப் போன்றது, அது வளர்ந்தால், டோப்டோ.
கலவை செயல்முறையின் மீளமுடியாத தன்மை செயல்முறையுடன் வரும் கலவை கூறுகளின் பரவலால் விளக்கப்படுகிறது. மீளமுடியாத உலகில் மாற்றத்தின் செயல்பாட்டில் என்ட்ரோபியின் அதிகரிப்பு.
ஊட்டச்சத்தை கட்டுப்படுத்தவும்
கலப்பதற்கான முக்கிய வழிகள் யாவை?
சுமிஷ் பெறுவதற்கான வழிகள் என்ன?
வெவ்வேறு கலவை முறைகளுக்கான மொத்த வெப்பநிலையை எவ்வாறு கணக்கிடுவது?
வாயுவின் அடியாபாடிக் ஏற்ற இறக்கத்தின் கீழ், என்ட்ரோபி தொகை ஏன் அதிகரிக்கும் என்பதை நீங்கள் எவ்வாறு விளக்கலாம்?
15. இரசாயன வெப்ப இயக்கவியலின் அடிப்படைகள்
ஒரு பன்முக அமைப்பு அதன் கூறுகளின் கிடங்கால் வகைப்படுத்தப்படுகிறது. பாடும் மனங்களுக்கு, இந்த கிடங்கை அமைப்பில் அறிமுகப்படுத்தப்படும் வேதியியல் மற்றும் இயற்பியல்-வேதியியல் மாற்றங்களின் ஏற்ற இறக்கங்களுக்கு மாற்றலாம், இதன் மூலம் பழையவை அழிக்கப்பட்டு அணுக்களுக்கு இடையில் புதிய பிணைப்புகள் உருவாகின்றன. இந்த செயல்முறைகள் இந்த பிணைப்புகளின் இரு சக்திகளின் பின்னணியில் சி இணைக்கப்பட்ட ஆற்றலின் தரிசனங்களுடன் சேர்ந்துள்ளன.
வேதியியல் வெப்ப இயக்கவியல் வேதியியல் மற்றும் இயற்பியல் மற்றும் வேதியியல் நிகழ்வுகளுக்கு வெப்ப இயக்கவியலின் முதல் மற்றும் பிற கோப்பின் வளர்ச்சியைப் பார்க்கிறது.
15.1. இரசாயன எதிர்வினைகள்
இரசாயன பேச்சு- ரசாயனக் கிடங்கின் மேக்ரோஸ்கோபிக் உடல், டோப்டோ. tіlo, schodo அத்தகைய ஒரு விஷயம் மட்டும் அல்ல, அத்தகைய இரசாயன கூறுகளிலிருந்து அத்தகைய விகிதத்தில் அது சேர்க்கப்படுகிறது ( தனிப்பட்ட இரசாயன பேச்சு); சுமிஷ்அல்லது ரோஸ்சின்).
வேதியியல் பேச்சு (அலமாரி) ஒரு இரசாயன சூத்திரத்தால் வகைப்படுத்தப்படுகிறது, இது எந்த உறுப்புகளிலிருந்து உருவாகிறது மற்றும் இந்த உறுப்புகளின் அணுக்கள் її தத்தெடுப்புக்காக உருவாகின்றன என்பதைக் காட்டுகிறது.
புதிய பேச்சுகளை உருவாக்க வழிவகுக்கும் ஓக்ரேமி வேதியியல் பேச்சுகளுக்கு இடையிலான தொடர்புகளின் செயல்முறைகள் அழைக்கப்படுகின்றன. இரசாயன எதிர்வினைகள்.
இது ஒரு இரசாயன எதிர்வினையாக இருந்தாலும், அது நேரடி மற்றும் தலைகீழ் திசைகளில் பார்க்க முடியும்.
மூடிய அமைப்புகளில், அமைப்பில் இருக்கும் தோல் இரசாயன கூறுகளின் அளவு மாறாத வகையில் இரசாயன எதிர்வினைகள் காணப்படுகின்றன. இரசாயன எதிர்வினைகள் போதிய உரைகளில் பங்கேற்காத காரணங்களுக்காக, ஆனால் ஸ்டோச்சியோமெட்ரிக் அளவுகள், பிறகு. kіlkostі, scho vіdpovіdat இரசாயன சூத்திரங்கள் பேச்சுகள். எனவே, வேதியியல் எதிர்வினைகள் பேச்சு எதிர்வினைகளின் வேதியியல் சூத்திரங்களுக்கும் எதிர்வினை தயாரிப்புகளின் வேதியியல் சூத்திரங்களுக்கும் இடையிலான சமத்துவங்களாக பதிவு செய்யப்படுகின்றன. வா ஆனால் 1 , ஆனால் 2 , …, ஆனால் n- வெளியீடு உரைகள், மற்றும் AT 1 , AT 2 , …, AT மீ- எதிர்வினைகளின் Kіntsev தயாரிப்புகள். பேச்சுகளுக்கு இடையே அதே இரசாயன எதிர்வினை ஆனால் 1 , ஆனால் 2 , …, ஆனால் n, உரையின் இறுதிவரை அழைத்தவர் AT 1 , AT 2 , …, AT மீ, சமநிலையின் பார்வையில் பதிவு செய்யுங்கள்:
Yakomu α 1, α 2, … α இல் n, β 1 , β 2 ... β மீ- ஸ்டோச்சியோமெட்ரிக் குணகங்கள். எடுத்துக்காட்டாக, மீத்தேன் எரிவதன் விளைவாக, கார்பன் டை ஆக்சைடு மற்றும் நீர் கரைக்கப்படுகின்றன:
CH 4 + 2O 2 \u003d CO 2 + 2H2O.
வேதியியலில் ஒரே அளவு பேச்சுக்கு, 1 ஏற்றுக்கொள்ளப்படுகிறது மைல்கள் இந்த அளவில், இந்த பேச்சின் குறிப்பிட்ட எண்ணிக்கையிலான மூலக்கூறுகள் (அணுக்கள்) உள்ளன, இது அவகாட்ரோவை விட பழையது. என் ஏ= 6.02204∙10 23 . வேறு வார்த்தைகளில் கூறுவதானால்: 1 மோல் பேச்சு வார்த்தையின் அளவாகக் கருதப்படுகிறது, இதன் நிறை கிராம்களில் M இன் மிகவும் விலையுயர்ந்த மூலக்கூறு (அணு) நிறை ஆகும்.
மடிப்பு அமைப்புகளின் கிடங்கு n நான்மச்சங்கள், வேதியியல் கேட்கிறது மோலார் பாகங்கள்அமைப்பு கூறு.
1. V=const இல் வாயுக்களின் கலவை. இவ்வாறு, மாற்றம் வரை மற்றும் அதற்குப் பிறகு வாயுக்களை ஆக்கிரமித்துக்கொண்டிருக்கும் மொத்த அளவு, மாற்றம் வரை மாறிலி மற்றும் வாயுவால் நிரப்பப்படுகிறது, V 1, V 2, ... .. V n m 3 வைஸ் p 1, p 2, p n і வெப்பநிலைகள் T 1 T n , மற்றும் இந்த வாயுக்களின் வெப்ப திறன்களில் மாற்றம் s r / s v k 1 , k 2 ,…. கே என்
வெப்ப நிலை
துணை
 (5.15)
(5.15)
வாயுக்களுக்கு, மோலார் வெப்ப திறன்கள் சமமாக இருக்கும், மேலும், k இன் சம மதிப்புகள் (62) மற்றும் (63) இப்படி இருக்கும்:
2. எரிவாயு நீரோடைகளின் மாற்றம். ஏற்ற இறக்கமாக இருக்கும் வித்ராதி நீரோடைகளின் நிறைகள் M 1, M 2, ... M n, kg / year, Vitrati இன் அளவு - V 1, V 2, ..... V n m 3 / வருடம், துணை வாயு - р 1 , р 2 , р n і வெப்பநிலைகள் - Т 1, Т 2, ... Т n, மற்றும் மற்ற வாயுக்களின் நீல வெப்ப திறன்கள் சமமாக இருந்தால் k 1, k 2, .... k n மொத்த வெப்பநிலை சூத்திரத்தால் தீர்மானிக்கப்படுகிறது:
 (5.18)
(5.18)
டி மற்றும் வைஸ் ஆர் வெப்பநிலையில் ஒரு மணி நேரத்தில் விட்ராட்டா தொகையின் அளவு:
 (5.19)
(5.19)
வாயுக்களுக்கு, k இன் மதிப்புகள் தெரிந்தால், கூட்டு வெப்பநிலை சூத்திரத்தால் தீர்மானிக்கப்படுகிறது (64). கே இன் அதே மதிப்புடன் வாயு பாய்கிறது என்றால், சூத்திரங்கள் (66) மற்றும் (67) இப்படி இருக்கும்:
 (5.21)
(5.21)
மேலாளர்
5.1. 1st cob mill t 1 \u003d 300 0 С க்கு t 2 \u003d 50 0 С க்கு மாறும்போது மீண்டும் 1 கிலோ உள் ஆற்றலில் ஏற்படும் மாற்றத்தை அறிய. தயவு செய்து kJ இல் தேதியைக் கொடுங்கள்.
உள் ஆற்றலில் ஏற்படும் மாற்றம் சூத்திரத்தால் அறியப்படுகிறது (5.9):
Du \u003d W vm (t 2 -t 1).
கோரிஸ்டுயுச்சிஸ் தாவல். 4.3, மதிப்பாய்வுக்குத் தேவை
(Z vm) 0 t =0.7084+0.00009349t kJ/(kg K);
(3 vm) 50300 = 0.7084 +0.00009349 (50 +300) = 0.7411 kJ / (kg K).
ஓட்சே,
Du = 0.7411 (50-300) = - 185.3 kJ / kg
விட்போவிட்: DU = - 185.3 kJ/kg
5.2. உள் ஆற்றல் 2 மீ 3 இன் மாற்றத்தை மீண்டும் அறிந்து கொள்ளுங்கள், இதனால் அதன் வெப்பநிலை t 1 \u003d 250 0 С முதல் t 2 \u003d 70 0 С வரை குறைகிறது. கோப் வைஸ் மீண்டும் P1 = 0.6 MPa.
விட்போவிட்: DU = -1063 kJ.
5.3. ருஹோமி பிஸ்டனுடன் சிலிண்டரில் வைக்கப்பட்ட வாயுவிற்கு, 100 kJ வெப்பம் அழைக்கப்படுகிறது. tsimu இல் விகோனன் வேலையின் மதிப்பு 115 kJ ஆகிறது. வாயுவின் உள் ஆற்றலை கணிசமாக மாற்றவும், இதன் விளைவாக செலவு 0.8 கிலோ ஆகும்.
விட்போவிட்: DU = - 18.2 kJ.
5.4. 0.5 MPa அழுத்தம் மற்றும் 50 0 C வெப்பநிலையில் 2 m 3 மறுபடியும் 0.2 MPa மற்றும் 100 0 C வெப்பநிலையில் 10 m 3 மறுபடியும் மாற்றப்படுகிறது. அழுத்தம் மற்றும் மொத்த வெப்பநிலையை அமைக்கவும்.
Vidpovid: t cm = 820С; Р cm = 0.25 MPa.
5.5. கொதிகலன் வீட்டின் தேர்ந்தெடுக்கப்பட்ட எரிவாயு ஃப்ளூவில், மூன்று கொதிகலன்களின் வாயுக்கள் படபடக்கின்றன, எது செல்ல வேண்டும், எது வளிமண்டல அழுத்தத்தை அழுத்த வேண்டும். எளிமைக்காக, அதே வாயு அதே கிடங்கைக் கொண்டிருக்கலாம் என்று ஏற்றுக்கொள்ளப்படுகிறது: CO 2 = 11.8%; O2 = 6.8%; N2 = 75.6%; H2O=5.8%. V 1 \u003d 7100 m 3 / ஆண்டு நிறுவ Vartov vitrati gazіv; V 2 \u003d 2600 m3 / ஆண்டு; V 3 \u003d 11200 m 3 / ஆண்டு, மற்றும் வாயுக்களின் வெப்பநிலை காற்றோட்டம் t 1 \u003d 170 0 С, t 2 \u003d 220 0 С, t 3 \u003d 120 0 С. வெப்பநிலை.
Vidpod: t = 147 0; வி \u003d 20,900 மீ 3 / ஆண்டு.
5.6. 0.1 MPa அழுத்தத்தில் மூன்று நீராவி கொதிகலன்கள் தேர்ந்தெடுக்கப்பட்ட எரிவாயு குழாயில் நகரும் மற்றும் புகை குழாய் மூலம் அவை வளிமண்டலத்தில் வெளியிடப்படுகின்றன. வாயுக்களின் வால்யூமெட்ரிக் கிடங்கு, தாக்குதல்களின் அடுத்த கொதிகலன்களிலிருந்து என்ன செல்ல வேண்டும்:
CO 2 = 10.4%; ப்ரோ 2 = 7.2%; N 2 = 77.0%; H2O=5.4%;
மற்றொருவரிடமிருந்து
CO 2 = 11.8%; O2 = 6.9%; N2 = 75.6%; H2O=5.8%;
மூன்றாவது
CO2 = 12.0%; O2 = 4.1%; N2 = 77.8%; H2O=6.1%.
Vartovі vitrati gazіv மடங்கு
எம் 1 \u003d 12000 கிலோ / ஆண்டு; M 2 \u003d 6500 கிலோ / ஆண்டு; எம் 3 \u003d 8400 கிலோ / ஆண்டு; மற்றும் வாயு வெப்பநிலை பொதுவாக t1 = 1300C; t 2 \u003d 1800C; t 3 \u003d 2000С.
தேர்ந்தெடுக்கப்பட்ட எரிவாயு குழாயில் மாற்றத்திற்குப் பிறகு வாயுக்களின் வெப்பநிலையை தீர்மானிக்கவும். இந்த வாயுக்களின் மோலார் வெப்ப திறன்கள் ஒரே மாதிரியானவை என்பதை ஏற்றுக்கொள்ளுங்கள்.
விட்போவிட்: t 2 \u003d 164 0 Z.
5.7. எரிவாயு குழாயில், மூன்று வாயு ஓட்டங்கள் உள்ளன, அவை அதே அழுத்தத்தை உருவாக்குகின்றன, இது 0.2 MPa ஆகும். முதல் ஓட்டம் 200 0 C வெப்பநிலையில் வைட்ராட்டா V 1 = 8200 m 3 / ஆண்டு அளவு கொண்ட நைட்ரஜன், மற்ற ஓட்டம் 500 0 C வெப்பநிலையில் கார்பன் டை ஆக்சைடு 7600 m 3 / ஆண்டு - 800 0 С வெப்பநிலையில் விட்ராட்டா 6400 மீ 3 / வருடத்துடன் மீண்டும் செய்யவும்.
Vidpod: t 1 = 423 0; V=23000 m3/வருடம்.
5.8. 500 0 С வரை குளிரூட்டல் மற்றும் உலர்த்தும் ஆலைக்கு நேராக காரணமாக 900 0 С வெப்பநிலையில் 400 கிலோ / வருடத்தில் நீராவி கொதிகலனின் வாயு குழாயிலிருந்து எரிப்பு பொருட்கள். 20 0 C வெப்பநிலையில் மீண்டும் வாயு ஓட்டத்தை ஓட்டத்துடன் கலந்து வாயுக்கள் குளிர்விக்கப்படுகின்றன. இரண்டு வாயு ஓட்டங்களிலும் அழுத்தம் ஒன்றுதான். R gas = R rev என்று அறியப்படுவதால், ஒவ்வொரு முறையும் ஆண்டு விட்ரட்டாவைக் கணக்கிடுங்கள். எரிப்பு பொருட்களின் வெப்ப திறன் சமமாக எடுக்கப்பட வேண்டும்.
பரிந்துரை: எம் திருப்பம். = 366 கிலோ/ஆண்டு.
அதே அழுத்தத்தின் கீழ் ஒரு சில தெர்மோஸ்டாடிக் பாத்திரங்களில் செல்லலாம் ப காசி ஆனால்і ATஎமோல் அளவுகளில் எடுக்கப்பட்டது. இந்த கப்பல்களை ஏற்றும் போது, முழு அமைப்பின் படி ஒரு சீரான எரிவாயு சேமிப்பு நிறுவப்படும் வரை வாயுக்களின் மிமிக் மாற்றம் இருக்கும். வாயுக்களின் வெளியீடும் அவற்றின் தொகையும் சிறந்த வாயுக்களுக்குச் சமமாக இருக்கும் என்று வைத்துக் கொள்வோம். நிரந்தர வாயு அழுத்தத்தைப் பாதுகாப்பதற்கான டோடி ப கூட்டுத்தொகையில் உள்ள வாயுக்களின் பகுதியளவு அழுத்தம், எதைக் குறைக்க வேண்டும், சமமாக இருக்கும்
பகலில் வெப்ப விளைவுகளில் சிறந்த வாயுக்களை மாற்றும் போது, வாயுக்கள் மற்றும் தெர்மோஸ்டாட் இடையே வெப்ப பரிமாற்றம் கட்டுப்படுத்தப்படாது, மேலும் அமைப்பின் என்ட்ரோபியில் ஏற்படும் மாற்றம் அமைப்பின் நடுவில் உள்ள செயல்முறைகளின் மீளமுடியாத தன்மையைக் குறிக்கும்.
என்ட்ரோபியின் மாற்றத்தை அறிய, விவரிக்கப்பட்ட மிமிக்ரி செயல்முறையை கணினியின் அதே கோப் மற்றும் எண்ட் மில்களுக்கு இடையே தெளிவான மாற்றத்துடன் ஒப்பிடுவது அவசியம்.
வாயுக்களில் சமமான முக்கியமான மாற்றத்திற்கு, இது ஒரு சிறப்பு அனுமான இணைப்பு மூலம் வேகப்படுத்தப்படுகிறது, ஒரு தெர்மோஸ்டாட்டுடன் ஒப்புமை மூலம், இது ஒரு கெமோஸ்டாட் என்று அழைக்கப்படுகிறது. . இந்த இணைப்பு ஒரு தெர்மோஸ்டாடிக் சிலிண்டரிலிருந்து மடித்து, பிஸ்டன் மூலம் தேய்க்காமல் நகரும்; சிலிண்டரின் அடிப்பகுதியில் இந்த தனிப்பட்ட வேதியியல் பேச்சுக்கு அதிர்வுறும் வகையில் ஊடுருவிச் செல்லும் ஒரு சவ்வு உள்ளது; ஒரு தனிப்பட்ட பேச்சின் தகனத்தில் இருக்கவும், ஒரு கெமோஸ்டாட்டில் zavantazhene, உரைகளின் சுருக்கம், இது திரிக்கப்பட்ட, மற்றொரு பாத்திரத்தில் காணப்படும். На відміну від термостата, призначеного для підтримки заданої температури зануреного в нього тіла, або для нагрівання або охолодження останнього в рівноважному режимі, за допомогою хемостату забезпечують підтримання певного значення хімічного потенціалу даної індивідуальної речовини досліджуваної суміші речовин, а також рівноважне підведення та відведення речовини з суміші . இரசாயன திறன் நான் கெமோஸ்டாட்டின் வேதியியல் கூறு வெப்பநிலையால் சந்தேகத்திற்கு இடமின்றி குறிக்கப்படுகிறது டிமற்றும் ஒரு துணை கொண்டு, நாம் பிஸ்டன்களில் உருவாக்குகிறோம். பிஸ்டன்களின் அழுத்தத்தை மாற்றுவதன் மூலம், தேர்ந்தெடுக்கப்பட்ட சவ்வு மூலம் இந்த கூறுகளின் மாற்றத்தை நீங்கள் நேரடியாக மாற்றலாம்: கூறுகளின் வேதியியல் திறன் கடைசி தொகையில் இருந்தால், பேச்சு எப்போது கூட்டுத்தொகையில் சேர்க்கப்படும், எப்போது - அது இருக்கும். கூட்டுத்தொகையில் இருந்து காட்டப்படும், மற்றும் கெமோஸ்டாட் கலக்கப்படும் போது. Kvazirivnovaga சவ்வு பக்கங்களிலும் சேர்த்து இரசாயன திறன் மதிப்பில் ஒரு சிறிய வேறுபாட்டின் கீழ் சவ்வு வழியாக பேச்சு பரவலான பரிமாற்ற வழக்கில் தொகைகளின் தொகையை மாற்ற.
ஒரு சிறந்த வாயுவின் இரசாயன ஆற்றல், வாயு ஒரு தனிப்பட்ட நிலையத்தில் அறியப்பட்டதா அல்லது மற்ற சிறந்த வாயுக்களுடன் கலவையில் உள்ளதா என்பதைப் பொருட்படுத்தாமல், வேறுபாடுகளால் வெளிப்படுத்தப்படுகிறது, டி ப நான்є அல்லது தூய வாயுவின் அழுத்தம், அல்லது தொகையின் பகுதி அழுத்தம். எனவே, ஒரு சிறந்த வாயு சவ்வு வழியாக மாற்றப்படும்போது, அது கூட்டுத்தொகைக்கு இடையில் சமமாக ஊடுருவுகிறது மற்றும் கெமோஸ்டாட்டில் சமமான அழுத்தம் மற்றும் தொகையில் உள்ள வாயுவின் பகுதி அழுத்தம் ஆகியவற்றால் வகைப்படுத்தப்படுகிறது.

அரிசி. 2.3 கூடுதல் கெமோஸ்டாட்களுக்கு இரண்டு வாயுக்களின் கலவையும் சமமாக முக்கியமானது: அ- கோப் மில் அமைப்பு; பி- வாயுக்களின் சமவெப்ப விரிவாக்கத்திற்கான ஆலை அமைப்பு; உள்ளே- சவ்வுகள் மூலம் zmіshuvannya gazіv பிறகு Kіntsevy ஸ்டான்; 1 - தனிப்பட்ட வாயுக்களின் வேதியியல் நிலைகள் ஏ மற்றும் பி ; 2 – napіvproniknі சவ்வுகள்; 3 - சமமான முக்கியமான வாயு கலவைக்கான பாத்திரம்.
சிறந்த வாயுக்களின் கலவையும் சமமாக முக்கியமானது ஏі பிஒரு தெர்மோஸ்டாடிக் அமைப்பில் மேற்கொள்ளப்படுகிறது, இதில் இரண்டு கெமோஸ்டாட்கள் மற்றும் தனிப்பட்ட கூறுகள் உள்ளன ஏі பி, மூன்றாவது பாத்திரத்துடன் - நாம் குடியேறும் தொகைகளின் கூட்டுத்தொகை, கெமோஸ்டாட்டைப் போலவே, ஒரு முரட்டு பிஸ்டன் (படம் 2.3) மூலம் பாதுகாப்போம்.
கீமோஸ்டாட்களில் உள்ள கோப் கணம் கூறுகளின் மோல் வடிவத்தில் அகற்றப்படட்டும் ஏஅந்த மோல் கூறு பிஅதே வைஸ் கீழ் ப
; சுமிஷியின் தேர்வில் உள்ள பிஸ்டன் பூஜ்ஜிய நிலையில் உள்ளது (பிஸ்டனின் கீழ் உள்ள வாயு பூஜ்ஜியத்தை அடைகிறது). கலவை செயல்முறை இரண்டு நிலைகளில் மேற்கொள்ளப்படுகிறது. முதல் கட்டத்தில், வாயுக்களின் சமவெப்ப விரிவாக்கத்தை மாற்றுவது அவசியம். ஏі பி; அழுத்தும் போது ஏபார்வை குறைக்க ப
முன்னரே தீர்மானிக்கப்பட்ட துணை மற்றும் துணை வரை பி vіdpovіdno vіd ப
முன். Obsyagi, scho முதல் மற்றும் பிற இரசாயனங்கள் உள்ள வாயுக்கள் zamayutsya, மாற்ற vіdpovіdno vіd to і іd க்கு . ஒரு ரோபோ, வாயுவால் பொல்லாதது, விரிவடைகிறது, முதல் கெமோஸ்டாட்டில், விலை அதிகம் ![]() ; இன்னொருவருக்கு
; இன்னொருவருக்கு ![]() . எனவே, எங்கள் அனுமான இணைப்பின் முதல் கட்டத்தில், ஒரு மொத்த வேலை மேற்கொள்ளப்படுகிறது. அதே உள் ஆற்றலின் சிறந்த வாயுவின் சமவெப்ப விரிவாக்கம் கொண்ட துண்டுகள் மாறாது; அமைப்பில் Zvіdsi பேச்சுவார்த்தைக்குட்பட்ட என்ட்ரோபி மாற்றம் சமமாக இருக்கும்
. எனவே, எங்கள் அனுமான இணைப்பின் முதல் கட்டத்தில், ஒரு மொத்த வேலை மேற்கொள்ளப்படுகிறது. அதே உள் ஆற்றலின் சிறந்த வாயுவின் சமவெப்ப விரிவாக்கம் கொண்ட துண்டுகள் மாறாது; அமைப்பில் Zvіdsi பேச்சுவார்த்தைக்குட்பட்ட என்ட்ரோபி மாற்றம் சமமாக இருக்கும்
செயல்முறையின் மற்ற கட்டத்தில் (காற்று கலவை), கெமோஸ்டாட்களிலிருந்து வாயுக்கள் தேர்ந்தெடுக்கப்பட்ட சவ்வுகளின் வழியாக ஓட்டத்தால் ஒத்திசைக்கப்பட்ட மூன்று பிஸ்டன்களின் சுருக்கங்களுக்கு கடுமையாக அனுப்பப்படுகின்றன. அதே நேரத்தில், தோல் பிஸ்டன்களுக்கு ஒரு நிலையான அழுத்தம் பயன்படுத்தப்படுகிறது, வெளிப்படையாக, மற்றும் கெமோஸ்டாட்கள் மற்றும் சேகரிப்பில், இது சவ்வுகள் வழியாக வாயுக்களின் சமமான பாதையை உறுதி செய்கிறது (இன்னும் துல்லியமாக, சேகரிப்பின் அழுத்தம் குறைவாக உள்ளது. ப , சவ்வு வழியாக பரவலின் அழிவு சக்தியில் பூஜ்ஜியத்தின் செல்வாக்கைச் சேமித்தல்). இந்த வழக்கில் மாறும் செயல்முறையின் தலைகீழ் மூன்று பிஸ்டன்களின் சுழற்சியின் ஒத்திசைவான மாற்றத்தின் சாத்தியக்கூறு மூலம் உறுதி செய்யப்படுகிறது, இது தனிப்பட்ட கூறுகளில் குழப்பத்தை ஏற்படுத்தும். அறுவை சிகிச்சை முடிந்த பிறகு, சுருக்கமாக, வெளிப்படையாக, தொகுதிகளின் சேகரிப்பில் இருந்து கடன்.
வெவ்வேறு இலட்சிய வாயுக்களின் துண்டுகள் எந்த வெப்ப விளைவுகளாலும் பாதிக்கப்படுவதில்லை, பகலில் செயல்பாட்டின் மற்றொரு கட்டத்தில் ஒரு தெர்மோஸ்டாட்டுடன் எங்கள் இணைப்பின் வெப்ப பரிமாற்றம். Otzhe, அமைப்பின் என்ட்ரோபியை மாற்றுவது சாத்தியமில்லை, .
Corisno ஒரு நேரடி pіdrahunk பாதையை கடந்து, மற்றொரு கட்டத்தில் எரிவாயு ரோபோ பூஜ்யம் அடையும். கெமோஸ்டாட்களில் பிஸ்டன்களை நகர்த்துவதற்கு ஒரு ரோபோ பயன்படுத்தப்படுகிறது என்பது உண்மைதான், அதே நேரத்தில், ரோபோவின் அதே அளவு மூலம் கலெக்டரில் வாயுக்கள் மேற்கொள்ளப்படுகின்றன. Zvіdsi.
மேலும், ஏற்ற இறக்கமான வாயுக்களின் விஷயத்தில் என்ட்ரோபியின் மொத்த அதிகரிப்பு வைரஸால் தீர்மானிக்கப்படுகிறது (2.9), . மாற்றத்தின் சமமான முக்கிய மாறுபாட்டுடன் கூட, வெப்பம் மற்றும் சமமான அளவு வேலையின் மாறுபாடு காரணமாக உறவுகளின் எண்ணிக்கையில் அதிகரிப்பு ![]() , பின்னர் வாயுக்களின் நேரடி (மீளமுடியாத) மாற்றத்துடன், என்ட்ரோபியின் அதே அதிகரிப்பு அமைப்பின் நடுவில் உள்ள தலைமுறை ஓட்டத்தால் இயக்கப்படுகிறது; கொள்ளையடிக்காத ரோபோ அமைப்பு இல்லை.
, பின்னர் வாயுக்களின் நேரடி (மீளமுடியாத) மாற்றத்துடன், என்ட்ரோபியின் அதே அதிகரிப்பு அமைப்பின் நடுவில் உள்ள தலைமுறை ஓட்டத்தால் இயக்கப்படுகிறது; கொள்ளையடிக்காத ரோபோ அமைப்பு இல்லை.
பதிலீட்டுக்குப் பிறகு (2.8) மற்றும் விராஸ் (2.9) என மாற்றி எழுதலாம்
 . (2.10)
. (2.10)
முரண்பாடான யோகா மூலம் வெப்ப இயக்கவியல் படிப்புகளில் spіvvіdnoshenyu vіdvoditsya obov'yazkové mіstse. என்ட்ரோபியின் மாற்றம் (சிறந்த வாயுக்களை மாற்றும் போது!) எந்த முக்கியத்துவமும் இல்லை என்பது குறிப்பிடத்தக்கது, இது அதிலிருந்து மாறுகிறது, மேலும் அத்தகைய அழுத்தம் மற்றும் வெப்பநிலையில் காற்று வீசுகிறது. உண்மையில், ஒரு முறைசாரா visnovok (2.10) இங்கே அறிமுகப்படுத்தப்பட்டது.
யோகோ பிரவுன் கல்வெட்டுகளுடன் visnovok (2.10) சேர்க்கப்பட்டது. கூறுகளின் மோலார் பகுதிகளை அறிமுகப்படுத்துதல் ![]() மேலும், 1 மோல் தொகைக்கு என்ட்ரோபியை ரோஸ்ரஹுங்காவாக மாற்ற விராஸை எடுத்துக்கொள்கிறோம், இது தீர்க்கப்பட்டது:
மேலும், 1 மோல் தொகைக்கு என்ட்ரோபியை ரோஸ்ரஹுங்காவாக மாற்ற விராஸை எடுத்துக்கொள்கிறோம், இது தீர்க்கப்பட்டது:
![]() . (2.11)
. (2.11)
செயல்பாட்டின் அதிகபட்ச மதிப்பு வாயுக்களின் சமநிலைத் தொகையான 0.5ஐப் பொறுத்தது.
கோட்பாட்டின் பார்வையில், உரைகளின் கூட்டுத்தொகையின் கீழ், கூறுகளின் அதிக எண்ணிக்கையிலான மோல்களைச் சேர்க்கும்போது என்ட்ரோபி அதிர்வுகளை மாற்றுவது எளிது. பிஒரு ஆசீர்வாத கூறு வரை ஏ. (2.10) ஐ கருத்தில் கொண்டு, நாங்கள் எடுத்துக்கொள்கிறோம்
(2.12) காட்டப்பட்டபோது, மடக்கைச் செயல்பாட்டின் கணித விளக்கக்காட்சி
 .
.
ஃபார்முலா (2.12) தொகையின் கடைசி விரிவாக்கம் வீட்டின் பாகத்தின் ஒரு மோலுக்கு விரிவாக்கத்தின் என்ட்ரோபியில் விவரிக்க முடியாத அதிகரிப்புடன் இருப்பதைக் காட்டுகிறது.
சூத்திரம் (2.10) வாயுவின் இறுதி அளவுகளை மாற்றும் போது என்ட்ரோபியின் அதிகரிப்பின் ஒருங்கிணைந்த மதிப்பைக் கொடுக்கிறது. வெப்ப பரிமாற்றத்திற்கான சூத்திரம் (2.7) போன்ற ஒரு சிறிய வேறுபாடு தீர்வுக்கு வர, கூறு கலவையின் மாதிரி (டிவி. படம் 2.4) மாற்றியமைக்கப்படுகிறது. கலவையானது இரண்டு கூறுகளுக்கும் ஊடுருவக்கூடிய சவ்வு வழியாக அல்லது தொகைகளால் நிரப்பப்பட்ட நீதிபதிகளைப் பிரிக்கும் குறுகிய வால்வு வழியாக அறிமுகப்படுத்தப்பட்டது என்பது ஏற்றுக்கொள்ளத்தக்கது. ஏі பிகிடங்கு. இந்த அமைப்பு தெர்மோஸ்டாடிக் முறையில் கட்டுப்படுத்தப்படுகிறது, மேலும் இரண்டு பாத்திரங்களிலும் துணை பிஸ்டன்களுக்குப் பின்னால் ஒரு நிலையான அழுத்தம் உள்ளது. ப . ஸ்வீடிஷ் தன்மையின் பரிமாற்றம் ஏற்பட்டால், நீதிமன்றங்களின் தோலில் சுமிஷியின் சேமிப்பு அதே உத்தரவின் நீதிமன்றங்களால் எடுத்துக்கொள்ளப்படலாம். இவ்வாறு, கொடுக்கப்பட்ட அமைப்பு பலவீனமான கடத்தும் பகிர்வுடன் வெப்ப பரிமாற்ற அமைப்புக்கு ஒத்ததாகும்.
சிரிப்போம் n வேதியியல் ரீதியாக ஊடாடாதது தங்களுக்குள் ஏற்றதாக வாயு வெப்ப இயக்கவியல் அளவுருக்களின் உதவியுடன் மாற்றம் மற்றும் மனம் மாறும் வரை நான் அனைத்து கூறுகளாக மாறுவேன் (தேவையான ஊடகத்துடன் இணைந்து மனம்). தெரிந்து கொள்ள வேண்டும் சமமாக முக்கியமானது அளவுருக்கள் மாற்றத்திற்குப் பிறகு வாயுவாக மாறும்
மாற்றுவதற்கான இரண்டு வழிகளைப் பார்ப்போம், எளிமைக்காக, செயல்முறை என்ன என்பதை கணக்கில் எடுத்துக்கொள்வோம் தேவையான ஊடகத்துடன் வெப்ப பரிமாற்றம் இல்லாமல் .
2.1 Zmіshuvannya மணிக்கு W=Const
இந்த மனநிலையில், நீங்கள் குழப்பமடையும் வகையில் உங்கள் மனதைக் கழுவுங்கள், நீங்கள் குடியேறுவீர்கள் டபிள்யூகூட்டுத் தொகைகளின் மொத்தத் தொகையைப் பார்க்கவும் டபிள்யூ எச் ஐ:
(வழி தவறியதற்கான தடயமும் இல்லை டபிள்யூ எச் ஐபகுதி கடமைகளுடன் வை, பத்தி 1.4.3 இல் விவாதிக்கப்பட்டது.)
குறிப்பிடத்தக்க வகையில்:
பி எச் ஐ- கோப் வைஸ் நான்-வது வாயு;
டி எச் ஐ,டி எச் ஐ- Pochatkova வெப்பநிலை நான்-வது வாயு 0 வரை ஏற்றது முன்புஅல்லது 0 Z.
ஏனெனில் முழு அமைப்பு nமனதில் zmіshuvanni கொண்ட வாயுக்கள் W=Const zdіysnyuє zvnіshnії ї raboty அல்ல, பிறகு நீங்கள் எழுதக்கூடிய முதல் அலைக்கு () வெப்ப இயக்கவியலின் முதல் கோப்பில் எழுதலாம்:
இங்கே: யுசெமீ - உள் ஆற்றல் சுருக்க வாயு நிறை மீசெமீ கிலோ
வெப்பநிலையுடன் டி 0 கே;
யு எச் ஐ- உள் ஆற்றல் நான்வது வாயு நிறை m iகிலோகிராம்கள்
மொட்டு வெப்பநிலையுடன் டி எச் ஐ .
குறியீட்டை அறிமுகப்படுத்துவோம்:
uசெமீ - சாதாரண வெப்பநிலையில் வாயுக்களின் தொகையின் உள் ஆற்றலை வழங்குதல் டி 0 கே;
u H i -செல்லப்பிராணி உள் ஆற்றல் நான்கோப் வெப்பநிலையுடன் கூடிய வாயு டி எச் ஐ .
டோடி சமன்பாடு (2.1.1) இது போல் தெரிகிறது:
(2.1.2)
பார்த்தபடி, ஒரு சிறந்த வாயுவுக்கு du=C v dT zvіdki at vіdlіku vіdlіku vіdlіshnyої ї vіd 0 0 முன்நீங்கள் எழுதலாம்:
இங்கே: - வரம்பில் சராசரி 0 டி 0 கேகூட்டு வாயுக்களின் வெகுஜன ஐசோகோரிக் வெப்ப திறன்;
வரம்பில் சராசரி 0 டி எச் ஐ 0 கேவெகுஜன ஐசோகோரிக் வெப்ப திறன் நான்வது வாயு.
மாற்றீட்டிற்குப் பிறகு (2.1.3) (2.1.2) நாம் எடுத்துக்கொள்கிறோம்:
இருப்பினும், பத்தி 1.4.10 வரை, மொத்த வாயுக்களின் நிறை வெப்பத் திறன் கூறுகளின் நிறை பின்னங்கள் மூலம் வெளிப்படுத்தப்படுகிறது. ஜி.ஐவரவிருக்கும் வரிசையில் அவற்றின் சரியான வெப்ப திறன்:
வரம்பில் உள்ள சராசரியைப் போன்றது 0 டி 0 கேவாயுக்களின் கூட்டுத்தொகையின் வெகுஜன ஐசோகோரிக் வெப்ப திறன் பின்வருமாறு குறிப்பிடப்படுகிறது:
சமன்பாட்டின் இடது பகுதிக்கு (2.1.4) இந்த வைரஸைப் பதிலாக நாம் எடுத்துக்கொள்கிறோம்:
நட்சத்திரங்கள் (2.1.5)
ஏனெனில் நான் சமமாகிவிடுவேன், பிறகு மாற்றுக்குப் பிறகு m iசமமான (2.1.5) வரை நாம் இன்னும் வெப்பநிலைக்கான சூத்திரத்தை எடுத்துக்கொள்கிறோம் nவாயு:
நீங்கள் பார்க்க முடியும் என, சூத்திரம் (2.1.6) ஒரு புண்படுத்தும் வழியில் எழுதப்படலாம்:
(0- வரம்பில் டிவிஆர் சராசரி என்ன என்று அடுத்த யூகம் டி எச் ஐ 0 கேகடைவாய்ப்பால் ஐசோகோரிக் வெப்ப திறன் நான்வது வாயு.)
மேம்பட்ட இலக்கியத்தில், வெப்பநிலையில் வெப்பத் திறனின் அனுபவப் படிவுகள் பெரும்பாலும் வரம்பிற்கு வழங்கப்படுகின்றன 0 t 0 С .
மாற்றீடு (2.1.8) மற்றும் (2.1.9) சமமான (2.1.2) வரை, நாங்கள் எடுத்துக்கொள்கிறோம்:
மாற்றுகிறது m iஇந்த மதிப்புகளுக்கு, டிகிரிகளில் மொத்த வாயு வெப்பநிலைக்கான சூத்திரம் செல்சியஸ் :
விஸ்லோவ்லூச்சி ஆர் ஐமூலக்கூறு எடை மூலம் மேலும் ஒரு சூத்திரத்தை கழிக்கிறோம்:
சூத்திரங்களின் அறிகுறிகளில் (2.1.6), (2.1.7), (2.1.10) மற்றும் (2.1.11) சராசரி வெப்பத் திறன் அளவிடப்படுகிறது, இதற்கு மேல் எல்லையானது கூட்டு வெப்பநிலையுடன் சராசரியாக கணக்கிடப்படுகிறது ( டிஅல்லது டி), நியமனத்தின் நோக்கம் என்ன. இதன் காரணமாக, கூட்டு வெப்பநிலை இந்த சூத்திரங்களால் தீர்மானிக்கப்படுகிறது கடைசி அணுகுமுறையின் முறை .
2.1.1. எரிவாயு ஏற்ற இறக்கங்களின் தனியார் ஏற்ற இறக்கங்கள் W=Const
சூத்திரங்கள் (2.1.6), (2.1.7), (2.1.10) மற்றும் (2.1.11) ஆகியவற்றின் சில எடுத்துக்காட்டுகளைப் பார்ப்போம்.
1. காஜிகள் உறும விடாதீர்கள், சில ஃபாலோக்கள் அடியாபதியைக் காட்டுகின்றன ஐ வரைவெப்பநிலை மாற்ற முடியும்.
(உண்மையில் முன்புஅதிகரிக்கும் வெப்பநிலையுடன் மாற்றங்கள், அதாவது வரை.
de குப்பை , அ- அனுபவ ரீதியாக நேர்மறை குணகங்கள்.
0 முதல் 2000 0 C வரையிலான தொழில்நுட்ப rozrahunkiv க்கு பின்வரும் சூத்திரங்கள் மூலம் கணக்கிடலாம்:
a) டையட்டோமிக் வாயுக்களுக்கு முன்பு 1,40 - 0,50 10 -4 டி;
b) எரிப்பு தயாரிப்புகளுக்கு முன்பு 1,35 - 0,55 10 -4 டி.
சூத்திரங்களின் பட்டியலிலிருந்து, அடியாபதியின் காட்சியில் வெப்பநிலையை செலுத்தியதைக் காணலாம். முன்புசெல்சியஸ் அளவை விட நூற்றுக்கணக்கான டிகிரிக்கு கீழே வெப்பநிலையில் குறைவாக கவனிக்கப்படுகிறது.
எனவே, யாக்சோ விடு, ஷோ
பின்னர் ஒரு புண்படுத்தும் தோற்றத்திற்கான சூத்திரம் (2.1.6):
சூத்திரம் (2.1.12) சூத்திரங்கள் (2.1.6), (2.1.7), (2.1.10) மற்றும் (2.1.11) ஆகியவற்றுக்கான முதல் தோராயமாக வெற்றி பெறலாம்.
2. வாயுக்கள் ஏற்ற இறக்கமாக இருக்கட்டும், அதற்காக மின்னல் மற்றும் ஐசோஹார்ன் வெப்பத் திறன்கள் சமமாக இருக்கும், மேலும் இந்த வெப்பத் திறன்களின் திரட்சியானது வெப்பநிலையால் பாதிக்கப்படலாம், எனவே:
டோடி சமன்பாடு (2.1.7) எளிமையானது போல் தெரிகிறது:
வாயுக்கள் சம மோலார் மற்றும் ஐசோகோரிக் வெப்பத் திறன்களைக் கொண்டிருப்பதால், அது மேயருக்குச் சமமாக இருக்கும்.
ஒருவருக்கொருவர் சமமான புட்டி மற்றும் சிறிய isobarnі வெப்ப திறன் காரணமாக, மேலும், adiabati, tobto சமமான அறிகுறிகள்.
உங்கள் மனதில், சமம் (2.1.12) (2.1.13) ஆக மாறுகிறது.
2.1.2. மணிக்கு வாயுக்களின் ஏற்ற இறக்கத்திற்குப் பிறகு டிஸ்க் W=Const
வாயுக்களின் ஏற்ற இறக்கத்திற்குப் பிறகு மீட்டெடுக்கப்படும் அழுத்தத்தை பத்தி 1.4.2ன் சூத்திரங்கள் அல்லது மனதால் தீர்மானிக்க முடியும்:
ஆர்செ.மீ டபிள்யூசெமீ = மீசெ.மீ ஆர்செ.மீ டி= மீசெ.மீ டி.
எங்கள் எரிவாயு நிலையத்தின் A, B மற்றும் C ஆகிய மூன்று கிடைமட்ட பந்துகளை நாம் தெளிவாகக் காணலாம், மேலும், விரிவாக்கப் பந்து A ஐ விட பெரியது, மேலும் A என்பது C. பந்து B. B ஐ விட அதிகமாக உள்ளது. கிடங்குகளில் இரண்டு தொகைகளில் பரப்பலாம் மற்றும் சி.
Tse zmіshuvannya என்று podіl dvoh gazіv zdіysniti і திருப்புமுனை வழி, A, B மற்றும் C கிடைமட்ட எக்காளங்களில் zmіtsnivshi இருக்க முடியும். பெயரின் எரிவாயு நிலையத்திலிருந்து வெளியேறும் அத்தகைய தோல் குழாயின் அந்த முடிவு, ஒரு பிஸ்டனுடன் மூடுகிறது. இப்போது பிஸ்டன்களை பி மற்றும் சி பந்துகளுக்கு நடுவில் வைத்து, அவற்றை விரைந்து, வலதுபுறம் கோபமாகச் சொல்லலாம், மேலும் ஏ புள்ளியில், மறுபுறம், பிஸ்டனை வலதுபுறம், பின்னர் வலதுபுறம் என்று அழைப்போம். . Todi B மற்றும் C deyakі மாசி வாயு pіdut zі stovpa, மற்றும் A, navpaki, nadіyde yakіs obsyag sumіshi. அத்தகைய தோல் குழாயில், அதே கிடங்கின் சுருக்கம் உள்ளது என்பதை நாங்கள் ஏற்றுக்கொள்கிறோம், இது ஒரு எரிவாயு நெடுவரிசையின் கிடைமட்ட பந்தாகும், அதனுடன் ஒரு குழாய் நினைவூட்டப்பட வேண்டும்.
![]()
ரிவ்நியனில் இருந்து ஒதுக்கப்பட வேண்டிய பொருள்
பின்வருவதைப் பாருங்கள்
![]()
இப்போது ஒரு ஓநாய் வழியில் தொகையைப் பிரித்து, கறை படிந்த ரோபோவை உற்சாகப்படுத்துவோம்.
A தனியாக obyagu sumishi, மற்றும் z i vevemo, vіdpovіdno, obyagi இல் அறிமுகப்படுத்தப்பட்டது
செயல்முறை மூலம் கறை படிந்த முழு வேலையும் விலை உயர்ந்தது
இந்த மதிப்பை மாற்றுவதன் மூலம், Bachimo, இந்த ரோபோ பூஜ்ஜியத்திற்கு சமம்.
இங்கே நுட்பமான ஒரு டியூஸ் உள்ளது: சுமிஷி மற்றும் யாக்ஸ் மீது சுமிஷ் A பிரிந்து விழுந்தது, உயரம் மற்றும் ப்ரிட்பாலியின் உயரத்தில் உயர்த்தப்பட்டது, அத்தகைய தரத்தில், ஆற்றலின் ஆற்றல். ஆனால் ரோபோ பூஜ்ஜியத்தை அடைந்து, கணினியின் வெப்பநிலை நிலையானதாக இருந்தால், அது குறைவாக இருக்கலாம், ஏனெனில் கணினி அதிக வெப்பத்தை கொடுக்கும் அல்லது எடுக்கும். சாத்தியமான ஆற்றலின் மாற்றத்தை அறிந்தால், வெப்பத்தின் அளவு, அமைப்பு மேம்படுத்தப்பட்டுள்ளது மற்றும் நட்சத்திரங்கள் மற்றும் என்ட்ரோபியில் ஏற்படும் மாற்றத்தை நாம் அறிவோம்.
கிடங்கில் சாத்தியமான ஆற்றல் அதிகரிப்பு
ஆனால் கணினியில் வெப்பத்தைச் சேர்ப்பது மிகவும் விலை உயர்ந்தது, அதனால் என்ட்ரோபியின் அதிகரிப்பு ஒன்றாக இருக்கும்
என்ட்ரோபியின் மொத்தத் தொகை மற்றும் மொத்தத் தொகை C என்பது என்ட்ரோபி யூனிட் மொத்தத் தொகை A ஐ விட அதிகமாகும். இது போன்ற அதிக என்ட்ரோபி யூனிட்டின் என்ட்ரோபியின் கூட்டுத்தொகை B மற்றும் C இன் மொத்தத் தொகையை அறிய முடியும். A; எதற்காக மொத்தத் தொகைகளான B மற்றும் Zஐத் தலைகீழ் சமவெப்ப வழி மூலம் கூட்டுத்தொகைக்குக் கொண்டு வர முடியும், இரண்டு தொகைகளின் என்ட்ரோபிகளின் அதிகரிப்பு, இதில் விராஸ் (75) க்கு சமமாக இருக்கும்.
மொத்த பங்குக்கான என்ட்ரோபி அதிகரிப்பு
![]()
![]()
இடைவெளியின் மூலம் இறுக்கத்திற்கான சமநிலை (76) விராஸில் பிரதிபலிக்கிறது