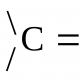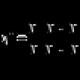Cletini budovi의 세포골격. 세포골격. 세포골격의 기능. Budov의 세포 골격. 크레센틴, 중간 필라멘트 단백질의 상동체
진핵 세포는 모양을 바꾸고 이동하며 세포질을 따라 소기관을 이동하고 유사 분열 중에 염색체를 분리합니다. Tsya zdatnіst에는 clitinum의 주요 아키텍처 인 cytoskeleton (및 cytomatrix로도 지정됨)을 형성하는 삼중 단백질 스레드 (필라멘트) 메쉬가 제공됩니다. 단백질 섬유는 진핵 세포 소기관의 원형질막 단백질에 대한 부착점이 없는 상태에서 진핵 클리틴의 세포질에 침투합니다. 모든 섬유는 특수 구형 단백질 인 소단위로 구성된 구조입니다. (클리틴과 같은 세포골격의 단백질 및 기타 단백질은 유전자에 암호화되고 리보솜에서 합성됩니다.)
세포골격의 하위 단위는 약한 연결(물, 이오님 및 기타)과 함께 연결되며 이 힘은 세포가 변화하기 쉬운 세포골격 구조의 동적 범위를 형성할 수 있게 합니다. 다른 클리틴 주입에서 우리는 구조의 주요 구성 요소를 분해하고 제거된 신호의 특성에 따라 새로 형성하여 세포 골격을 변경할 것이라고 표시됩니다. 동시에 조직의 전체 계획을 보존하기 위해 세포골격의 상세한 수명이 끊임없이 변화하고 있습니다. 이러한 형태의 로봇 세포골격 시스템을 동적 불안정성의 원리라고 합니다.
필라멘트의 직경에 따라 마이크로필라멘트(5~7nm), 중간 섬유(약 10nm) 및 미세소관(약 25nm)의 세 그룹으로 나뉩니다. 피부 유형의 세포골격 구조는 주 단백질과 부 단백질이 있는 전원 시스템에 의해 음핵에서 확립됩니다. 시스템의 시스템은 절대적으로 독립적이며 클리틴의 원형질막, 핵 및 기타 클리틴 오가노이드와 같은 클리틴의 구성 요소 중 하나와 서로 상호 작용합니다. 명확한 징후에 따르면, 세포골격은 음핵의 하위 형태뿐만 아니라 모든 유형의 세포질 루히비뿐만 아니라 음핵의 다른 부분에도 부착하고 효소에 의해 중간 음핵으로 신호를 안전하게 전달합니다. 공간의 세포 수용체.
마이크로필라멘트 zustrіchayutsya는 실질적으로 모든 유형의 클리틴에 있으며 진핵 생물 클리틴에서 가장 널리 퍼진 단백질 액틴에서 형성됩니다. (액틴은 전체 세포 단백질의 약 5%를 구성하고, 골격 고기에서는 음핵 질량의 약 20%를 차지합니다.) 액틴은 겉보기에 단량체로 대체될 수 있습니다(G-액틴은 375개의 아미노산으로 구성된 "구형 액틴"입니다. 잔류물) 또는 섬유(F-액틴 - "원섬유 액틴"). 가죽 F-액틴 필라멘트는 마이크로미터의 작은 스프랫의 나선형 구조를 나타냅니다. F-액틴의 섬유는 두 가지 다른 전하를 가질 수 있으므로 서로 다른 소용돌이로 중합됩니다. 빠르게 성장하는 키넷을 플러스 키넷이라고 하고 상당히 성장하는 키넷을 마이너스 키넷이라고 합니다. Plus-kinets 액틴 필라멘트 성장은 10배 빠르고 마이너스 키넷은 낮습니다.
마이크로필라멘트는 점막 침체, 비언어 세포, 식균작용, 난자와 함께 정자가 응집되는 과정에서 루호모믹 세포 및 첨체에서 세포질 증식의 확립과 같은 동적 과정에 참여합니다. 이 모든 과정은 액틴 결합 단백질의 도움을 받아 수행됩니다.
세포질에서 클리틴은 G-액틴 및 F-액틴과 특이적으로 상호 작용하는 50가지 이상의 다양한 유형의 액틴 결합 단백질을 가지고 있습니다. 단백질은 기능이 다양합니다. G-액틴 풀(프로필린)을 조절하고, F-액틴 필라멘트를 안정화(프라진)하며, 필라멘트를 세포골격의 다른 구성 요소와 바느질합니다. 활성 액틴 결합 단백질, 예를 들어 겔 형성(젤리와 같은 단어) - 액틴 섬유를 십자형으로 삐걱거리고 동시에 솔에서 세포질 세포를 옮깁니다(라틴어 솔루티오 - rozchin에서). ) 젤에 넣습니다. 또 다른 액틴 결합 단백질은 포드린(fodrin)이라고도 불리는 스펙트린(spectrin)으로, 액틴 섬유를 다발로 묶어 세포질 막과 근위 섬유에서 유도된 메쉬에 부착합니다. 발린 단백질은 액틴 필라멘트를 동일한 구조의 순서에 평행하게 결합하고 G-액틴 중합의 매끄러움에 묻힙니다.
Mayzhe clitiny의 모든 유형의 ruhiv는 액틴 결합 단백질 미오신의 참여와 관련이 있습니다. 모든 미오신 분자에는 머리, 목, 꼬리가 있습니다. 미오신 머리는 ATP의 존재로 인해 액틴 I 단량체에 부착되어 플러스 마이너스 미세 필라멘트에서 붕괴됩니다. 골격 조직에서 액틴과 미오신 분자는 차례로 고정 표면에 흩어져 있으며 액틴 필라멘트를 따라 미오신 머리가 움직이면 막이 짧아집니다. 독일어 클리틴에서 미오신 단백질과 상호 작용할 때 액틴 필라멘트는 빠르게 움직이는 다발을 형성할 수 있으므로 정맥은 클리틴 표면의 함입(함입)에 의해 확립됩니다. 예를 들어 rozpodil_ clitin. 클리틴의 폐허의 성질은 미오신 단백질의 형태로 놓여 있으며, 그 구조는 80가지 이상의 변이가 있을 수 있습니다. 미오신 및 기타 액틴 결합 단백질의 다양한 변이체와 액틴 마이크로필라멘트를 결합하여 클리틴은 구조, rukhlivistyu 및 안감의 시간을 담당하는 구조를 형성합니다.
대부분의 클리틴 마이크로필라멘트는 소위 액틴 피질(actin cortex)이라고 하는 원형질막 삼중 구조를 제압합니다. 구조의 구조 및 마이크로 필라멘트의 재생의 특징; 예를 들어, 백혈구의 피질에서 필라멘트는 5초 이상 발견되지 않습니다. rukhomi clitinums의 주요 피질 중단 유형
pseudopodia - 세포질 증식. Pseudopodia는 편평판(lamelopodia), 좁은 실린더(phylopodium) 또는 협측 미추르(buccal michur)의 형태를 취할 수 있습니다. pseudopodia의 형태는 microfilaments 및 원형질막과 상호 작용하는 액틴 결합 단백질 유형에 있습니다.
액틴 마이크로필라멘트는 접이식 접을 수 있는 열린 공간 및 그렇지 않으면 안정적인 세포골격 구조에 참여합니다. 예를 들어, 장과 니록의 상피 세포의 미세 융모의 기초는 액틴 필라멘트 다발에 의해 형성됩니다. 유모 세포의 윗면에서 내이의 계곡은 마치 소리를 일으키는 것처럼 성장 (모발)의 전문화 인 입체 섬모를 변경합니다. 스테레오실은 악기의 파이프인 오르간처럼 규칙적인 줄로 배열되어 있습니다. 내부의 빈 모발 입체섬모는 액틴 필라멘트와 다른 단백질 분자로 가득 차 있습니다. 단백질 수를 암호화하는 이러한 유전자의 돌연변이는 유모 세포의 퇴화를 초래하고 난청의 형태 중 하나로 나타납니다(어셔 증후군).
마이크로 필라멘트는 러시아 문화에 적극적으로 참여합니다. 액틴 필라멘트가 클리틴의 거친 가장자리 끝에서 서서히 중합되면 내부에서 해중합됩니다. F-액틴의 중합 및 해중합 과정은 곰팡이 수달(독소)에 의해 중단될 수 있습니다. 예를 들어, 팔로이딘(곰팡이 독소)은 마이너스 종류의 액틴과 결합해 해중합을 억제하고, 사이토칼라신(강력한 세포증식억제제인 곰팡이균 독소)은 플러스 종류가 되어 액틴의 중합을 차단한다. 액틴 필라멘트의 중합 또는 해중합을 방해하는 트리발륨 주입 연설은 이러한 세포를 죽게 합니다.
액틴의 중합은 정확히 과정의 조절, 세포의 추가 표면 수용체, 효소(단백질 키나아제) 및 칼슘 이온의 조절입니다. 이 과정의 중단은 임상 증상을 동반합니다. 예를 들어, 형질전환된 세포에서는 액틴 접힘을 조절하는 단백질 발현에 변화가 있습니다. 액틴 필라멘트의 현저한 이상이 일부 사악한 퍼프의 클리틴에서 관찰됩니다. 육종 클리틴(행복한 조직의 팽창)에서 얇고 짧은 액틴 필라멘트의 존재가 밝혀졌습니다. 정상적인 클리틴의 표면에 있는 기클리틴은 더 썩고 전이되기 전에 건강이 좋을 수 있습니다.
중간 필라멘트노래하는 클리틴 유형(예: 상피 세포의 케라틴, 건강한 조직 세포의 비멘틴, 악성 조직 및 조직의 데스민)에 특이적인 단백질로 구성됩니다. 중간 필라멘트는 클리틴의 조직을 제공하므로 악취는 미세하고 섬유질이며 폴리펩티드의 스트레칭에 저항하고 클리틴의 세포질 전체에 퍼져 메쉬의 mi를 만족시킵니다. 또한 세포질 섬유는 핵에 존재하여 핵공과 밀접한 관련이 있는 핵막 내면의 필라멘트 배열(라미나)을 만족시킵니다.
중간 섬유의 구조 요소는 단백질로, 최대 5개의 고유 과에 속하며 높은 수준의 클리틴 특이성을 나타냅니다. 이러한 단백질의 전형적인 대표자는 사이토케라틴, 데스민, 비멘틴, 산성 섬유성 아교단백질 및 신경필라멘트입니다. 모든 단백질은 중심 부분 근처에 α-나선과 같은 기본 전단 구조를 가지고 있습니다. 두 개의 펩타이드 랜스(다이머)가 슈퍼코일을 형성합니다. 이러한 이량체는 역평행 방식으로 결합하여 사량체를 구성합니다. "헤드 투 헤드(head to head)" 원리에 따른 테트라머의 응집은 원형필라멘트를 제공한다. Vіsіm protofіlamentіv는 한 번에 접합되고 직경 10 nm의 utavlyuyut 중간 섬유입니다. 중간 필라멘트의 탄성은 진피 사량체의 이량체가 체크 순서로 하나씩 확장된다는 사실에 의해 보장됩니다.
사람의 머리카락과 손톱, 양털, 피르야, 골, 파주르, 생물의 보물은 케라틴(시토케라틴)의 머리 등급에 의해 형성됩니다. 하나의 섬유에는 수백만 개의 섬유가 얽혀 있습니다. Okremi lanceugs 케라틴은 수많은 이황화 결합으로 결합되어 추가 경도를 제공합니다. 인간 상피 세포에서 두 가지 유형을 결합하는 30개 이상의 서로 다른 케라틴이 발견되었습니다. 또한, 머리카락과 손톱에 특이적인 중요한 케라틴의 모든 동형이 설명되었습니다. 신경 클리틴에서는 오래된 축삭에 필요한 기계적 지원을 제공하기 위해 신경 필라멘트가 개발됩니다. 골격 악성 sarcomeres의 Z 디스크에서 desminal 확장의 필라멘트. 다양한 유형의 클리틴에서 중간 필라멘트는 자폐 클리틴을 형성하는 데스모좀이라고 하는 클리틴 접촉 형성에 중요한 역할을 합니다. Napivdesmosomes는 악취가 나는 썩은 상피 세포를 기저막에 부착합니다.
미세소관
모든 진핵생물의 클리틴에 존재하는 미세소관은 긴 실 모양의 구조로 전체 세포질을 따라 뻗어 있으며 선을 형성하여 이러한 소기관의 구조적 구성과 위치를 향상시킵니다.
미세소관은 heterodimer인 protein tubulin(lat. tubula - tubule)의 중합과정에서 용해되어 subunit으로 용해된다. α- і β- 튜 불린. 중합 공정에서 α -한 이량체 접촉의 튜불린 β -승인된 원형필라멘트와 함께 전진하는 이량체의 튜불린. 나선형으로 진행되는 13개의 늦은 관형 필라멘트(실) 열은 직경이 24nm이고 마이크로미터의 긴 스프랫을 가진 미세소관을 설정합니다.
쌀. 튜불린 폴리펩타이드가 일대일로 연결되어 원통형 벽을 형성하는 방법을 보여주는 미세소관 형성 계획. A. 가로 섹션 B - 미세소관의 짧은 섹션.
미세소관 내의, 더블렛і 세 쌍둥이.
ㅏ이중선 또는 삼중선에 대한 미세소관은 13개의 원형 필라멘트로 구성됩니다.
세관 비і 씨더 적은 수의 원형 필라멘트로 구성되며 10이라고 부릅니다.

미세 소관의 중합은 미세 소관이 동일한 극성을 갖도록 머리에서 꼬리까지 똑바로 진행됩니다. її kintsі는 플러스 마이너스 킨트로 표시됩니다. 클리틴의 미세소관은 불안정합니다. 악취는 빠르게 집어 올릴 수 있습니다. klittsі 마이너스 -kіntsі pov'yazanі z 조직 센터 미세 소관 (TSOMT) - 구조, roztashovanoї bіlya 핵, 생물 kіtinakh - tsentriole, utvernih z 미세 소관에서 두 개의 작은 몸을 복수하는 것을 좋아합니다. 일반적으로 미세소관은 다른 단백질(미오신, 다이네인, 키네신)과 결합하여 미세소관을 세포골격 및 소기관의 더 작은 요소와 연결합니다. Kinezin은 음핵의 한 부분에서 미세소관의 플러스 포인트에서 마이너스 포인트로, 그리고 마이너스 포인트에서 플러스 포인트로 다이네인으로 소기관 및 소포(전구)를 수송합니다.
Vіdomі khіmіchnі spoluki, zdatnі는 미세 소관 (colchicine, vinblastine)의 접힘을 차단하고 안정적인 미세 소관 (taxol)의 형성을 자극합니다. 세포의 미세 소관 접힘이 손상되면 마음이 접힐 수 있습니다 (너무 신맛이 나지 않거나 온도가 낮아지거나 상승하는 등). 세포의 미세 소관 접힘이 중단되면 정상적인 발달로 인해 발생할 수 있습니다.
액틴 필라멘트와 같은 미세소관은 원시 형태의 세포에 참여합니다. 정적 기능 순서대로 미세소관은 모든 진핵생물의 클리틴에서 일어나는 다양한 과정(감수분열, 유사분열, 음핵세포 및 분비)에 참여합니다. 악취는 소기관 수송을 위한 직접적인 "슬레이트"입니다. 관련 단백질과 함께 미세소관은 기계적 작업, 예를 들어 미토콘드리아의 수송, 시냅스 구근의 움직임, rux vii(다리, 장 및 난관의 상피에서 세포의 머리카락 같은 성장) 및 정자를 생성합니다. Golgi 장치에 의해 설립 된 Pukhirtsі는 적응증에 따라 미세 소관을 따라 세포의 다른 세포로 곧장 이동합니다. 또한, 유사분열 스핀들 형태의 미세소관은 진핵 클리틴의 분포에서 딸 클리틴 사이의 염색체의 정확한 분포를 보장하는 장치의 가장 중요한 부분입니다.
미세소관의 기능: 1) 절단 시 염색체 분포를 보장합니다. 2) podtrimka 양식 clitiny; 3) 거대 분자 및 소기관의 수송에 참여; 4) 편모의 취약성 확보, viy.
세포골격의 기능
세포골격에는 세 가지 주요 기능이 있습니다.
1. 음핵에 전형적인 형태를 부여하고 막과 소기관 사이의 연결을 고정시키는 음핵 기계적 프레임 역할을 합니다. 프레임은 변화하는 마음의 세계에서 끊임없이 업그레이드되고 성직자가 되는 역동적인 구조입니다.
2. 클라이언트의 움직임을 위한 Dіє yak "모터". Dviguni(짧은) 다람쥐는 m'yazovyh clitins 및 기타 조직에서 발견됩니다. 세포골격의 구성 요소는 움직임, rozpodil, 성장 과정에서 클리틴 형태의 변화, 소기관의 움직임 및 세포질의 움직임을 직접 조정하고 조정합니다.
3. 세포 한가운데에 있는 소기관 및 기타 거대 복합체를 수송하기 위한 "레일" 역할을 합니다.
마이크로 필라멘트 및 중간 섬유.
F-액틴에 의해 자극된 미세섬유는 미세융모를 관통하여 매듭을 형성합니다. 이 마이크로파이버는 모든 핌브린과 빌린 중에서 가장 중요한 추가 화이트와 결합됩니다. Calmodulin 및 myosin-like ATP - aza는 극미세 섬유를 원형질막과 연결합니다. .
Clitina는 세포골격의 합성 단백질 세트를 휴경 방식으로 변경할 수 있지만 프로세스가 더 발전했습니다. 세포골격의 디자인은 실의 중합과 해중합으로 인해 새로운 분자의 합성 없이 쉽게 변경될 수 있습니다. 세포에서는 세포질에서 스레드와 다양한 단백질-단량체의 지속적인 교환이 있습니다. 풍부한 클리틴에서는 액틴과 튜불린 분자의 약 절반이 세포질 모노머에 위치하고 절반은 마이크로필라멘트 주름에 들어갑니다. Clitina는 중합의 안정성을 변경하는 특수 단백질을 부착하여 세포 골격 실의 안정성을 조절합니다. 세포골격 기능의 기본 원리는 동적 불안정성입니다. 예를 들어, 양면 오목 디스크와 같은 적혈구의 모양은 단백질 스펙트린으로 적정되는 막질의 섬유질 세포골격에 의해 지지됩니다. 음이온(Cl - , HCO - 3)의 수송을 담당하는 세포질막의 단백질과 결합하는 단백질 안케린(앵커-야키르)과의 결합 스펙트럼. 단백질 스펙트린과 안키린의 결함은 비일차 형태의 적혈구를 유발합니다. 이러한 적혈구는 이미 비장에서 빠르게 붕괴되고 있습니다. 질병, yakі vyklikayutsya 그러한 porushennyami, 구상 세포증 슬럼프 또는 eliptocytosis 슬럼프라고합니다.

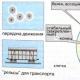
쌀. 진핵생물의 세포골격. Actin microfilaments는 chervonium, microtubules - greens, clitin nuclei - black color로 바뀝니다.

세포골격은 미세소관, 미세섬유 및 중간 필라멘트의 세 가지 구성 요소로 구성됩니다.
미세소관클리틴의 전체 세포질에 침투합니다. 그들로부터의 피부는 직경 20-30nm의 빈 실린더입니다. 미세소관의 벽은 나선형으로 하나씩 꼬인 13개의 실(프로토필라멘트)로 덮여 있습니다. 흑색의 피부 실은 튜불린 단백질의 이합체(dimer)로 구성됩니다. 튜불린의 합성은 과립형 EPS의 막에서 일어나고 나선형으로 접히는 것은 클리틴 중심에서 발생합니다.
분명히 많은 미세소관이 중심소체를 향해 방사형으로 향할 수 있습니다. 악취의 소리가 세포질 전체에 퍼집니다.
더 많은 미세소관이 고정될 수 있고("-") 더 많은("+") 말단이 될 수 있습니다. Vіlny kіnets zabezpechuє podovzhennya는 세관을 잘랐습니다. 통해, 뿐만 아니라 염색체의 중심. 일반적으로 세포질의 미세소관이 부풀어 오르고 악취는 1 µm/min의 속도로 클리틴 중심에서 녹습니다. Ruinuvannya 미세소관을 생산하여 세포의 모양을 변경합니다.(Tvarinna kіtina nabuvaє 소리 구형). 이 경우 음핵과 소기관의 구조가 깨집니다.
클리츠에서 미세소관은 다음을 확장할 수 있습니다.
okremih 요소의 시야에서;
악취가 가로 패치 (신경 성장)로 하나씩 묶인 묶음에서;
Ø 쌍 또는 이중선 창고 (vіy 및 jgutikіv의 축 스레드);
Ø 창고 삼중항(중심소체 및 기저체).
나머지 두 변종에서 미세소관은 종종 하나씩 융합됩니다.
미세소관의 기능:
a) 세포의 모양과 극성 유지
b) 셀 구성 요소의 혼합 순서를 보장합니다.
c) 접을 수 있는 다른 소기관(중심소체, 얇은 정맥)의 발달에 참여;
d) 세포내 수송에 참여;
e) 유사 분열성 음핵염의 경우 염색체 이동 방지;
e) ruhu viy의 보안.
마이크로필라멘트. 미세 필라멘트는 직경이 있는 흰색의 가는 실이라고 합니다.5~7nm,모든 유형의 세포에서 실용적입니다. 악취는 다발, 그물 모양의 공 또는 하나씩 세포질에 퍼질 수 있습니다.
마이크로필라멘트의 주요 단백질은 액틴이며 종종 전체 단백질 양의 5%까지 차지합니다. Krim new, 마이크로필라멘트 창고에는 미오신, 트로포미오신 및 수십 개의 활성 결합 단백질이 포함될 수 있습니다. 액틴 분자는 두 개의 나선형으로 꼬인 실처럼 들립니다. 피질 메쉬는 특수 단백질, 예를 들어 필라미나의 도움으로 서로 서로 교차하는 일종의 미세 필라멘트로 원형질막 아래에 중간없이 주름져 있습니다. 대뇌 피질 라인은 액틴 분해 효소의 참여로 단계적으로 변화하는 클리틴 형태의 변화의 매끄러움에 의해 형성됩니다. Tim 자신은 기계적 주입으로 클리틴의 날카롭고 격렬한 변형을 바꾸지 않을 것입니다. 대뇌 피질 막의 Okremi 미세 필라멘트는 클리 티나를 세포 간 언어의 구성 요소 또는 다른 클리 틴과 연결하기 때문에 소위 접착 층 (초점 접촉)뿐만 아니라 원형질 막의 일체형 및 막 횡단 단백질에 부착됩니다. . 미세 필라멘트는 물리적 및 화학적 주입에 더 강하고 미세 소관이 낮습니다.
마이크로필라멘트의 주요 기능:
1) 마이크로필라멘트의 피질 메쉬에 대한 음핵의 노래 강성과 탄력성을 보장합니다.
2) 졸이 겔로 전이되는 시간을 포함하여 세포질의 농도 변화;
3) 세포내이입 및 세포외이입에 참여;
4) 액틴의 조절된 중합 후 클리틴 표면의 형태 변화를 기반으로 하는 비언어 클리틴(예: 호중구 및 대식세포)의 취약성을 보장합니다.
5) 수명이 짧은 m'yazovykh clitin 및 섬유의 운명;
6) 가교된 액틴 필라멘트 다발(미세융모, 입체섬모)에 의해 보호되는 원형질막의 국소 주름의 안정화;
7) 세포 간 포자 형성에 참여 (재 씹는 데모 좀 및 in).
중간 필라멘트는 흰색 로프 실로 짜여져 있습니다.10nm에 가까운 zavtovshki.이러한 포카즈닉은 미세소관과 미세필라멘트 사이의 중간 질량의 도입을 확대했습니다. Promіzhnі filamenti utavlyayut trivіrіnі merezhі살아있는 유기체의 다른 조직의 세포에서. 악취는 핵을 스며 나오게 하고 세포질의 다른 구획에 있을 수 있고, 세포간 격막(데스모솜 및 나피베데스모솜)을 만들고, 신경 세포의 중간에서 자랍니다.
중간 필라멘트의 주요 기능:
1) 구조적;
2) 지원
3) 음핵의 노래 세포에서 소기관의 세분화 기능.
세포골격은 세포의 지지 주름 시스템을 형성하는 미세소관 및 미세필라멘트와 같은 실 모양의 단백질 구조의 모음입니다. 세포골격은 진핵 세포만 될 수 있으며, 원핵 세포(박테리아)에는 아무 것도 없으며, 이는 이 두 유형의 세포 사이의 중요한 차이점입니다. 클리틴싱의 세포골격은 딱딱한 클리틴 벽의 출현을 위해 형성됩니다. Vіn은 amoeboid rush의 기초가되는 세포질 (소위 원형질 오버런)에 ruh organoids를 구성합니다. 세포골격은 클리틴의 모양을 변경할 필요 없이 쉽게 변경할 수 있습니다. 클리틴의 형성은 초기 단계에서 클리틴 층의 누적 변위의 형태를 변화시킨다. 배아 발달. 언제 rozpodіlі kіtini ( 유사 분열) 세포 골격이 "분해"(해리)되고 딸 클리틴에서 자체 접힘이 갱신됩니다.
세포골격에는 세 가지 주요 기능이 있습니다.
1. 음핵에 전형적인 형태를 부여하고 막과 소기관 사이의 연결을 확보하는 음핵의 기계적 틀 역할을 합니다. 프레임은 변화하는 마음의 세계에서 끊임없이 업그레이드되고 성직자가 되는 역동적인 구조입니다.
2. 클라이언트의 움직임을 위한 Dіє yak "모터". Dviguni(짧은) 다람쥐는 m'yazovyh clitins 및 기타 조직에서 발견됩니다. 세포골격의 구성 요소는 움직임, rozpodil, 성장 과정에서 클리틴 형태의 변화, 소기관의 움직임 및 세포질의 움직임을 직접 조정하고 조정합니다.
3. 세포 한가운데에 있는 소기관 및 기타 거대 복합체를 수송하기 위한 "레일" 역할을 합니다.
24. 세포골격의 천공에서 면역세포화학 방법의 역할. 악성 세포에서 세포 골격 조직의 특성.
면역세포화학적 분석은 클리틴의 형태 보존을 염두에 두고 세포학적 물질의 면역학적 분석을 수행할 수 있는 방법입니다. ICC는 면역화학법의 익명 유형 중 하나입니다: 효소 면역측정법, 면역형광법, 방사면역측정법. ICC법의 기본은 항원과 항체에 대한 면역학적 반응이다.
진핵생물의 클리틴의 세포질은 세포골격이라고 하는 단백질 필라멘트(필라멘트)의 trivum과 같은 네트워크로 침투되어 있습니다. 필라멘트의 직경에 따라 마이크로필라멘트(6-8nm), 중간 섬유(약 10nm) 및 미세소관(약 25nm)의 세 그룹으로 나뉩니다. 모든 섬유는 특수 구형 단백질의 하위 단위로 형성된 고분자입니다.
마이크로필라멘트(액틴 필라멘트)는 진핵 세포에서 가장 넓은 단백질인 액틴으로 구성됩니다. 액틴은 모노머(G-액틴, "구형 액틴") 또는 폴리머(F-액틴, "원섬유 액틴")로 사용될 수 있습니다. G-액틴은 2개의 도메인으로 구성된 비대칭 구형 단백질(42kDa)입니다. 이온 강도 운동의 세계에서 G-액틴은 가역적으로 응집하여 선형-나선형 고분자인 F-액틴을 비틀어 버립니다. G-액틴 분자는 ATP(ATP) 분자에 결합되어 있는 ATP(ATP) 분자를 운반하는데, F-액틴으로 1시간을 지나면서 ADP(ADP)로 가수분해된다. F-actin은 ATP-ase의 힘을 보여줍니다.
B. 중간 섬유의 단백질
중간 섬유의 구조 요소는 단백질로, 최대 5개의 고유 과에 속하며 높은 수준의 클리틴 특이성을 나타냅니다. 이러한 단백질의 전형적인 대표자는 사이토케라틴, 데스민, 비멘틴, 산성 원섬유 아교단백질[CFGP(GFAP)] 및 신경필라멘트입니다. 모든 단백질은 수퍼 코일 α-나선과 같은 중앙 부분 근처에 기본 전단 구조를 가지고 있습니다. 이러한 이량체는 역평행과 결합하여 사량체를 형성합니다. "헤드 투 헤드(head to head)" 원리에 따른 테트라머의 응집은 원형필라멘트를 제공한다. Vіsіm protofіlamentіv utvoryuyut 산업용 섬유.
미세섬유 및 미세소관의 표면에서 중간 섬유의 단량체는 세포질 근처에서 좁아질 가능성이 없습니다. 중합은 안정한 비극성 폴리머 분자의 용해도를 유도합니다.
V. 튜불린
미세소관은 α- 및 β-서브유닛의 이량체인 구형 단백질 튜불린으로부터 형성됩니다. 튜블린 단량체는 GTP(GTP)에 결합하여 GDP(GTP)를 가수분해합니다. 두 가지 유형의 단백질이 미세소관과 관련되어 있습니다: 구조 단백질, lk-전위자.
세포골격에 대한 바로 그 논의는 1920년대에 등장한 20세기 초 저명한 러시아 세포학자인 Koltsov에 의해 처음 제안되었습니다. 세포 골격의 요소는 모든 진핵 생물의 클리틴에 줄무늬가 있으며 이러한 구조의 유사체 축은 원핵 생물에서 1입니다. 다른 클리틴에서 세포골격 요소의 다양성 수준. 예를 들어, 표피 세포는 특히 근위 필라멘트가 풍부합니다. 고기 섬유에는 액틴 미세 필라멘트가 더 많고 미세 소관은 신경 세포, 색소 세포의 성장에서 더 줄무늬가 있습니다. 세포골격 요소의 압도적인 힘은 다투지 않고 표면적을 늘리고 파괴하는 단백질 원섬유 폴리머입니다. 세포 골격 요소의 이러한 불안정성은 세포의 부서짐을 초래합니다. 예를 들어 양식을 변경하십시오. 특수 첨가제 단백질이 포함된 세포골격의 활성 구성 요소는 프레임워크 역할을 하는 접힘 원섬유 앙상블을 안정화하고 설정할 수 있습니다. 운동 단백질 또는 전위자로 볼 수 있는 다른 특수 단백질과 상호 작용할 때 세포 골격 구성 요소는 다양한 세포 장애에 참여할 수 있습니다.
세포골격은 세 개의 하위 시스템으로 구성됩니다. 악취는 기능 당국을 위해 창고, 초 구조를 위해 싸우는 것입니다. 미세 필라멘트 시스템(액틴-미오신), 미세소관 시스템(튜불린-다이네인) 및 중간 필라멘트 시스템(10nm 필라멘트).
마이크로필라멘트생물의 무너져가는 세포의 세포질에 있는 다발, 따라서 피질 공(원형질막 아래) 자체, 그리고 성장하는 세포와 곰팡이는 붕괴되는 세포질 공에서 자랍니다. 주요 미세섬유 단백질은 액틴 단백질입니다. Tse 복잡한 kіlkoh bіlkіv. 이 복합체의 피부 단백질은 자체 유전자에 의해 암호화됩니다. ATP 분자에 복수하는 G-액틴의 단량체 형태(구형)의 두 가지 유형의 액틴이 보입니다. G-액틴이 중합되는 동안 약 8미크론 크기의 얇은 피브릴이 형성됩니다. 이 구조를 F-액틴이라고 합니다. 액틴 마이크로필라멘트는 그들의 지배력에 대해 극성입니다. Tse 동적 구조, yakі는 spіvvіdnennia 구형 및 원 섬유 액틴에서 휴경 방식으로 선택 및 분석 될 수 있습니다.
클리틴의 불안정한 원섬유 시스템은 F-액틴과 상호 작용하는 많은 추가 단백질에 의해 안정화됩니다. 예를 들어, 단백질 트로포미오신은 여러 액틴 실의 상호 작용을 보장하여 경도를 부여합니다. 단백질 필라민과 알파-액티닌은 F-액틴의 실 사이에 교차 연결을 설정하여 접을 수 있는 사소한 메쉬를 형성합니다. Tsya merezh nadaє gelepodіbnogo 나는 세포질이 될 것입니다. 다른 보충 단백질은 필라멘트 번들을 묶을 수 있습니다. 예를 들어, 단백질 핌브리나. 또한 미세 필라멘트와 상호 작용하여 썩는 것을 방지하기 때문에 단백질이 사용됩니다. F-액틴과 다른 보충 단백질의 상호 작용은 마이크로필라멘트의 집합 상태를 조절하여 보풀이나 navpaki, 심지어 썩는 것으로부터 보호합니다. І 다른 구성 요소와의 상호 운용성을 확보하십시오.
나는 액틴 회색 단백질 미오신과의 상호작용에서 특별한 역할을 합니다. Vіn은 추가 단백질로 가져 오지 않습니다. Vin은 액틴 시스템의 또 다른 주요 구성 요소입니다.
미오신은 유사한 단백질 계열입니다. 이 모든 단백질에서 구조는 ATPase에 대한 복합체의 활동을 나타내는 머리 부분과 운동 부분을 가지고 있는 것으로 보입니다. 미오신 단백질의 또 다른 구성 요소는 조절 단백질에 의해 데칼코마에 결합된 자궁경부입니다. 세 번째 구성 요소는 미오신의 피부 유형에 따라 다르며 이 단백질의 기능을 나타내는 꼬리 부분입니다.
전체 미오신 복합체는 미오신 I, 미오신 II 및 미오신 V의 세 가지 유형으로 나뉩니다.
미오신 I. 단량체 분자입니다.
Myosini II와 V는 이합체입니다. 꼬리 부분의 일부는 소위 알파 초나선 구조를 구성합니다. 2개의 미오신 II 분자는 서로 상호 작용하여 피브릴을 형성할 수 있습니다.
미오신 I과 V는 예를 들어 소포 수송에서 막의 세포질 상호 작용에 참여합니다. 마이크로필라멘트 시스템의 주요 단백질인 이들 단백질의 상호작용 메카니즘은 미오신 머리와 액틴 필라멘트의 상호작용에서 시작하여 미오신 분자의 소실과 원거리 변위를 초래한다.
피부 주기 동안, 미오신 머리는 액틴 필라멘트의 양의 끝에서 5-25nm 만큼 한 ATP 분자의 가수분해로 직접 이동합니다. 이것은 미오신 분자와 함께 액틴 필라멘트의 직접적인 단조 때문입니다. Tsya 모델 원위 이름 모델 Huxley. 위조 분자 이론.
십자형 smugasti m'yazovі 섬유는 zbіshenoyu 모델 mikrofilamentu입니다. 그려지는 어둡고 밝은 컷이있는 1-2 미크론의 실이있는 근원 섬유. 혼자, budovi myofibril є 사르코미르또는 두 개의 Z 디스크 또는 흰색 사이의 dilyanka. Z 디스크의 기능은 혈관 구조 사이의 연결과 유사합니다. Z-단백질 자체는 짧은 구조입니다.
편안한 상태에서 sarcomeres의 확산은 1.8에서 2.8 미크론까지 다양합니다. Uzdovzh sarcomere roztashovuyutsya protofibril 세 조각. 얇고 액틴 스레드처럼 Z 디스크로 묶여 있습니다. 나는 myosin 분자로 표현되는 tovstі 스레드입니다. Roztashovuyutsya tovstі 스레드는 액틴 스레드 사이의 간극에서 야크입니다.
미오신 분자의 머리는 액틴 필라멘트와 상호 작용하고 두 개의 독립적인 단백질의 상호 작용의 결과로 액틴-미오신 복합체를 형성합니다. 풍부한 접힘에서 이들 복합체의 활성은 하나의 단백질인 미오신의 ATPase 활성보다 큽니다.
근섬유의 단축은 Z 디스크 사이의 변화에 의해 영향을 받습니다. 토브토. 근절의 길이는 약 20인치 정도 짧아집니다. myofibrils의 길이 이후 모든 sarcomeres의 협력 단축의 단축의 메커니즘. 짧음의 기초는 미오신 실이 액틴 실 사이의 틈에 들어가 Z 디스크에 접근하는 하나의 얇고 두꺼운 실의 움직임입니다.
세포골격 창고에 있는 미세섬유 시스템의 기능은 다음과 같습니다.
1) 취약성을 보장하는 클리틴의 빠르게 움직이는 장치의 정착.
2) 액틴(G-액틴 및 F-액틴)의 중합 및 해중합 과정에서 젖은 손으로 축적되는 골격 구조의 성형.
3) 세포 내분비 및 세포 외분비 및 세포 절제술(rozpodil tila clitinis) 과정에서 기계적 움직임.
세포 골격의 또 다른 근골격 부분 - 튜불린 시스템 또는 미세소관 시스템.미세소관 시스템은 이전에 조사된 액틴-마이오신 시스템과 매우 일관성이 있을 수 있습니다. 그녀와 마찬가지로 우선 중합과 해중합을 구축합니다. 다른 방법으로 흰색 실의 극성도 가능합니다. 셋째, 많은 추가 단백질이 있습니다.
시스템의 주요 단백질은 튜불린입니다. 튜불린은 이종이합체입니다. 알파 및 베타 튜 불린의 두 부분으로 구성됩니다. 협회 utvoryut 잘 단백질 튜불린 동안 제나라 소단위.
중합 과정에서 튜불린 분자는 베타 소단위가 알파 소단위와 상호 작용하고 알파 소단위가 베타 소단위와 상호 작용하는 방식으로 결합됩니다.
이러한 분자는 원형 필라멘트의 긴 스레드에서 하나씩 vishikovuyutsya입니다.
동시에, 원형 필라멘트가 길이로 조정되면, 중합 중에 폭의 증가가 관찰된다. 확인 순서대로. 최대 13개의 원형필라멘트를 프린지합니다. 후기 원형필라멘트는 빈 튜브로 꼬여 있으며, 이러한 피부 모노머 튜불린은 5nm의 선형 크기를 특징으로 합니다. 정착된 실린더의 실제 직경은 약 25nm입니다. 세포질에서 4개의 튜불린 분자가 중합되어 나타나는 이러한 미세소관의 축을 단일 미세소관이라 한다. Tse 동적 구조. 동적 불안정성- 튜브의 특성을 찾습니다. 악취가 빠르게 올라오고 빠르게 올라옵니다. 이 과정은 세포에서 단일 및 조직화된 미세소관 분자의 스파이빙을 내려놓는 것입니다.
단백질 튜불린의 농도가 충분하면 중합이 자발적으로 일어나고 중합 정도는 미세소관 말단 중 하나에서 일어날 가능성이 더 높으며 이를 양성 말단이라고 합니다. 튜불린 농도가 충분하지 않으면 미세소관이 양방향으로 분리됩니다. 미세소관의 분리는 먼저 온도를 낮추고 다른 방식으로 이 과정은 칼슘 이온의 존재에 따라 달라집니다.
그들은 튜불린 분자 선택의 무작위성을 나타내는 언어 유형, 알코올성 식물의 뿌리를 봅니다. 가장 광범위한 알칼로이드 콜히친. Tsya 음성 vzaimodiє z okremi tubulin 및 zabigaє 중합 분자. 인생의 중간 시간은 약 5배 더 깁니다. 그러한 캠프는 pritamanny interfazi입니다. kіntsi에 Okremі 미세 소관, shcho 성장, podzhuyutsya zі swidkіst 4-7 미크론 / 퀼, 그리고 dosit shvidko 단축. 14-17㎛/m. 분열하는 세포에서 미세소관은 특정 구조로 조립됩니다. 그들은 딸 세포 사이에 유전 물질을 퍼뜨리는 과정을 보장하는 무색 방추로 구성됩니다. achromatic spindle 창고에서 microtubules의 수명은 15-20초에 불과합니다. 미세소관의 불안정성은 GTP 가수분해의 폐색 때문이라는 것이 중요합니다. 그러나, 미세소관의 20%는 분화된 세포에서 20년의 겉보기에 안정적인 스트레치로 점유됩니다. 튜불린의 변형으로 인한 안정성 때문입니다.
미세소관 자체는 수명이 짧지 않으며, 단백질은 내부 수송을 위한 obov'yaskovy와 같은 세포질의 미세소관과 같은 즉, 편모, 아래의 무색 스핀들과 같은 붕괴하는 세포 소기관의 일반적인 점성 성분입니다. 수송 세포내이입.
hyaloplasm에 국한된 세포질 단일 micronemia는 clitin 형태의 안정화에서 골격 (골격)과 거친 골격의 두 가지 기능을 제공합니다. 한 조각 한 조각 디자인으로 음핵은 모양을 잃고 자루가 됩니다. 내부 음핵 조직을 구성하는 미세소관은 운동 지향 내부 세포 구조의 기능자입니다.
미세소관의 모터 역할은 악취가 정렬된 벡터 운동 시스템을 생성한다는 사실에서 중요한 역할을 합니다. 미세소관의 양성 말단은 세포 중심에서 주변으로 곧게 펴집니다. 그리고 다이네인이 있는 미세소관의 양극 및 음극 방향 극단이 모두 존재하면 주변에서 중심으로 클리틴의 구성 요소를 옮길 가능성이 생깁니다.
미세소관은 미세소관 조직 센터(MCMT)에서 자랍니다.
이 센터에서 미세소관은 특수 식물에서 성장을 시작하고 극성으로 성장합니다. 미세소관의 양의 방향이 자랍니다. 생물의 클리틴에 있는 COMT와 마찬가지로 메인 랭크는 클리틴 센터 또는 중심체 매트릭스의 운명을 결정합니다. 그들의 부정적인 끝으로 미세소관은 COMT에 고정되고 그 안에 고정됩니다. cim의 영향으로 일련의 미세 소관으로 둘러싸여 있어야 하는 특수 단백질과의 상호 작용을 이해하는 것이 필요합니다. 성장이 더 큰 클리틴에서 미세소관의 중합은 클리틴 핵의 주변을 따라 확장되며, 이 경우 세관은 방사상으로 분기됩니다.
대부분의 경우 생물의 간기 세포에서 새로 생성된 유기체와 미세소관의 성장은 특별한 빛처럼 보입니다.
1) 미세소관은 viy, 중심소체 및 편모, rux viy 및 암캐 편모의 창고로 들어가는 조직화된 구조로 형성됩니다.
2) 미세소관은 세포가 분리될 때 바닥에서 무색 방추의 실로 조직화됩니다.
3) 중세포, 이동막, 분비 및 수송 단백질 및 오가노이드의 수송을 자극합니다.
4) 성숙할 필요가 없는 음핵의 Є 세포골격.
강의: 클리틴 센터(중심체)
중심체 또는 클리틴 센터는 1875년 플레밍에 의해 발견되었습니다. 1876년 - 베네덴. 클리틴의 기하학적 중심에 있는 Roztashovuyutsya. 악취는 생물의 특징입니다. 더 큰 로슬린, 더 낮은 버섯 및 가장 단순한 버섯에는 그런 것이 없습니다. 클리틴 센터에는 커플에서 소리가 나는 중심소체의 다른 작은 공간이 있습니다. 한 쌍의 centrioles는 diplosome입니다. 이 한 쌍의 중심소체에서 방향은 일대일로 수직입니다. 이중체는 방사상으로 얇은 피브릴(중심구)이 있는 가벼운 세포질로 날카로워집니다.
budіvlі tsentrіolі의 기초는 스테이크 9 개의 세 쌍둥이 미세 소관에 접혀 있습니다. 너비가 약 0.15 미크론이고 바닥이 0.3 - 0.5 미크론인 빈 실린더의 9개의 삼중항이 있습니다. 삼중항의 첫 번째 미세소관은 a-미세소관이라고 합니다. 바로 미세소관입니다. 다른 하나는 세 번째 미세소관입니다. 기억나지 않습니다. 악취는 11 개의 protofilaments를 복수하고 vprituly는 일대일로 인접합니다. 즉, zadnuє microtubules є zagalnoy dilyanka입니다.
가죽 삼중 스티치는 실린더 상단에서 실린더 반경까지 약 40도 아래에 있습니다. 미세소관은 튜불린에서 접혀 있습니다. 센트리올 창고에 대한 튜불린 크림에는 단백질 다이네인으로 표시되는 추가 구조가 포함됩니다.
소리, 쌍극체 창고 근처의 간기 세포에서 어머니 중심과 딸을 봅니다. 딸은 모체 중심소체의 후축에 수직으로 자랍니다. 센터롤의 중앙 부분에서 소위 슬리브는 흰색 넥신으로 표시됩니다. 넥신은 직피 3중선에 9개의 뜨개질바늘을 뜨개질바늘이라고 하는 베일 모양을 하고 있다. 스포크가 있는 중앙 허브 중앙에 있는 볼륨은 3/4에서 1/5까지 취할 수 있습니다. 모체 중심소체 형태의 일련의 쌍극체는 모체 중심소체의 부속물 또는 위성이라고 불리기 때문에 무정형의 바이로시티(virosity) 물질로 나타납니다. 딸의 부속물에는 아무 것도 없습니다.
centrioles의 microtubules 시스템은 공식 9 + 0으로 설명됩니다. 미세 섬유 매트릭스의 중심 소체 근처에는 미세 소관이 얽힌 클러치가 있습니다. Mufti에는 위성(=최근 위성)이 있습니다. 악취는 트리코 발의 원섬유 구조로 형성됩니다. 바닥은 머리를 들고 있습니다. 다른 사람들과 접촉하십시오. 인공위성은 미세소관이 접혀 있는 원심분리기입니다.
이러한 외교 형태는 제공되지 않습니다. 모든 것이 여전히 플라스틱 구조입니다. Budov에 따르면, 그 중심체의 활동은 클리틴 주기 동안 휴경지에서 급격하게 변합니다.
클리틴 주기시간은 젖은 podіlu의 її에 셀의 소원의 개암 나무 열매에서 호출됩니다.
기간: rozpodil(핵 rozpodil 및 세포질 rozpodil)은 클리틴 주기의 약 1/7 부분이 됩니다. 그리고 reshta - 바닥 준비 기간 (간기).
클리틴 주기의 피부 단계는 고유한 신진대사 및 형태 특성이 특징입니다.
시간 아래 세포에는 2개의 중심체가 있습니다. 음핵은 4개의 중심소체를 가질 수 있으며, 악취는 2개의 이중체처럼 음핵의 극에서 퍼집니다. 유사분열의 모든 단계에서 모계 중심소체는 얇은 피브릴로 표시되는 약 0.3μm 너비의 넓은 영역으로 날카로워집니다. 이 영역은 centriolar fibrillary halo. 미세소관은 이 후광을 통해 방사상으로 들어갑니다. 딸 중심소체에 후광이나 미세소관이 없는 것이 중요합니다. 이러한 이중체는 유사분열 장치의 방추를 형성하는 기능을 악용합니다. 무색 스핀들.
디플로좀의 중심구인 디플로좀 영역은 미세소관(COMT)의 조직 또는 중합의 중심인 중심주위 매트릭스라고 합니다. centrioles의 첫 번째 활동 형태.
Centrioles - 미세 소관의 중합 중심. 말기가 끝날 때까지 세포질이 실제로 클리틴에 의해 파괴되면 염색체가 탈축합되기 시작하고 새로운 딸핵이 형성됩니다. 무색 스핀들이 붕괴되고 스핀들의 튜브가 해중합됩니다. clitin centri는 또한 구조를 변경하고 모성 및 딸 centrioles 자체는 서로 수직입니다. 2 미크론까지 가변. G1 기간 동안 속대에 위성이 형성되고 이를 통해 미세소관이 방사상으로 들어갑니다. 중심소체는 세포질 미세소관 형성을 위한 매개체가 됩니다. 성장의 세계에서 미세소관은 중심소체 영역과 연결되어 있으며 미세소관은 세포질에서 한 시간 동안 자유롭게 발견됩니다. 나는 음핵에서 컨베이어 변화와 세포질 미세 소관의 재생산이 있습니다. 세포의 울타리가 공격 단계로 넘어가는 순간 평온 단계(G0 기간)가 됩니다.
부착 단계로의 클리틴의 전이는 축삭으로 채워진 비리스트 원형질막을 형성하는 구조로서 클리틴 센터의 기능에 대한 기능을 합니다. Axoneme - 축 스레드.
축삭은 9개의 이중 미세소관으로 접혀 있으며, 이 미세소관은 중심소체에서 자라며 말뚝을 따라 방사형으로 확장되며 피부 이중선에서 고르지 않은 미세소관을 볼 수 있습니다. 크림은 미세소관의 이중체입니다. 즉, 축 또는 중앙 실린더 형태의 첨가제 단백질 넥신과 같은 모양의 두 개의 단일 중앙 미세소관이 존재하는 것이 특징입니다. (9+2). Centrioli는 기저체의 기능을 이겼습니다.
현재 기간 S에서 클리틴 센터는 한 가지 형태의 활동을 더 이기고 중심 소체 자체의 수가 증가합니다. centriole의 증식은 그들의 rozpodil과 관련이 없지만 피부 centriole에 수직인 명백한 centriole의 벽에 형성되기 때문에 rudiment 또는 procentriole의 설정 방식에 의해 형성됩니다. 9개의 단일 미세소관이 뒷면에 놓이고 악취가 9개의 이중선으로 변환된 다음 9개의 삼중선으로 변환됩니다. 이 확장을 중복이라고 합니다. 머리 뒤쪽의 이러한 구조 성장으로 인해 우리가 어머니의 크기까지 자라면서 짧은 딸 중심 역할이 설정됩니다. S기에는 복제와 동시에 모체 중심소체가 계속해서 세포질 미세소관을 형성합니다.
피부 중심소체의 복제 과정의 결과로 새로운 중심소체가 성장합니다. 중심 소체의 복제는 트리거링 메커니즘 또는 DNA 분자의 복제 신호입니다. S 기간이 완료된 후 Klitz는 이미 두 개의 Diplosome을 변경했습니다.
그런 다음 클리틴 주기가 시작됩니다. 상승 직전의 합성 후 기간. 어머니의 졸업장에서 똑같은 위성을 알고 있습니다. 공격적인 모체 중심소체는 원섬유형 후광으로 덮여 있으며 이제 유사분열 미세소관을 형성하기 시작합니다.
진홍색, 세포질에는 올바른 형태의 미세 소관과 클리틴이 분해됩니다. 클리티니, 하찮은 재생산까지 쌓이듯, 악취는 주기를 반복한다. 음핵이 스테이션 G 0 기간에 머무르면 중심 역할은 먼저 세포질 미세 소관의 중합 과정에서 다른 방식으로 세관 순환 장치의 채택에 참여합니다.
Вії특수 상피 세포 또는 자유 부유 세포 및 기본 정맥에 전형적인 운동 섬모증의 두 그룹으로 세분됩니다.
Via는 300nm의 일정한 직경을 가진 세포질의 얇은 원통형 바이러스입니다. 원형질막으로 코팅의 바닥에서 상단까지 Virist. 성장 중간에 튜불린과 다이네인을 주성분으로 하는 축삭의 구조가 발달하였다.
세포질에있는 vії zanurenny의 하부 근위 부분은 기초체. 기저체의 축색 직경은 동일합니다. axoneme은 그것의 창고에 axonemic 실린더의 외벽을 구성하는 9개의 이중선을 가지고 있습니다. 미세소관의 이중선은 axonemic radius와 관련하여 약 10도 정점 아래에서 약간 회전합니다. 이중선에서 미세소관은 13개의 원형필라멘트로 구성된 A 미세소관과 정확히는 아니지만 11개의 원형섬유로 구성된 B 미세소관으로 균등하게 나뉩니다. A-미소관은 봉합 이중선에서 B-미소관으로 향하는 자체 강도를 유지합니다. 첨가제 단백질의 핸들을 다이네인에 성형합니다. 9-12개의 폴리펩티드 랜스로 구성되어 있으며 2-3개의 구형 머리로 대체될 수 있으며 더 많은 타원형 선형 인대에 의해 한 번에 연결되는 큰 단백질 복합체에 의한 표현의 데네인. 피부 머리 다이네이누는 ATP 분자와 상호 작용하는 활성 중심을 가질 수 있습니다. 중앙 실린더 중앙에 있는 A-미세소관에서 방사형 보조 단백질이 중앙 실린더로 들어가는 스포크를 형성하는 것처럼 들어갑니다.
기저체는 중심체와 마찬가지로 부도프와 동일합니다. 핸들, 부싱 및 스포크는 기초 몸체의 하부에 꿰매어져 있습니다. 원형질막에 인접한 기저체의 연장부에는 피부 삼중항을 통해 원형질막으로 이동하고 음핵 조직과 연결되는 9개의 부속물이 있습니다. 따라서 기저체와 vіya는 구조적으로 일대일로 연결되어 하나의 전체가됩니다. 기저체의 삼중체에 있는 A- 및 B-미소관은 축삭의 이중체에서 A- 및 B-미세소관으로 계속됩니다. 그리고 vіdmіnі 하나 vіd 하나의 내부 부분의 축은 vіyu posterіgayut 무정형 가로 판, 즉 중앙 미세 소관의 축삭 성장 영역에서 기저체의 전이 영역에서 자주 발생합니다. Вії 서두르지 마십시오. 악취가 죽어 싸우고 있습니다. tsomu rusі dіneїn є moto-and-bo에서 ruhovym 다람쥐와 함께. 다인을 튜불린의 서브유닛과 연관시킬 때, 나중에 단조 이중선이 하나 또는 다른 것으로 관찰됩니다. 미세소관의 머리는 양극단에서 음극단으로 이동하고 이중혈관은 정맥의 상단으로 이동합니다. 미세소관의 이중선은 추가 단백질로 하나씩 중앙 미세소관 쌍에 연결됩니다. vії의 상단이 아니라 가발을 생산하기 위해 자전거 상단에있는 이중선의 이러한 협력 교체. 이 과정은 에너지 집약적입니다.
다른 기관의 도움을 위해 많은 박테리아가 파괴됩니다. 체 세균성 편모 또는 편모. 박테리아 편모는 근본적으로 실행 가능합니다. 악취 mayut 접이식 Budov. 그들은 편모의 외부 긴 섬유질 실, 기저체 및 기저체의 세 가지 주요 부분으로 구성됩니다. jgutikov 스레드는 다람쥐에서 flagelin으로 회전했습니다. 요가 vіd 40-60 yew의 분자량. 플라젤린의 구형 소단위체는 나선형으로 꼬인 실로 중합되어 구조가 확립됩니다. 직경 12 - 25nm. 중간에 비어 있습니다. 편모의 다람쥐는 흠집이 나지 않습니다. 악취는 나선형의 노래 크로크와 함께 나선형 실에서 자발적으로 중합될 수 있습니다.
편모 박테리아의 음핵 표면 근처에서 후크라고 불리는 넓은 음모로 이동하십시오.
Dovzhina 압정은 45nm에 가깝습니다. 와인은 다른 단백질에서 합산됩니다.
박테리아 기저체는 족쇄로 묶인 가위와 두 개의 "디스크"로 구성됩니다. 하나의 링은 리포사카라이드 막에 있는 zanuren이고 다른 하나는 murein 영역에 있습니다. 단백질 복합체의 다른 zanurenі. 진핵생물에서 편모는 이중체의 후기 루후의 너구리 뒤에서 편모가 무너진다. 박테리아에서, 편모의 편모는 원형질막의 평면에 있는 축을 중심으로 기저체의 rachnx를 넘어 확장됩니다. Ruh dzhgutikiv는 ATP에 있습니다.
세 번째 창고 부분 - 10nm 중간 필라멘트. 악취는 원섬유성 단량체에서 나옵니다. 중간 필라멘트의 주요 디자인은 몸통을 고정할 수 있는 로프를 추측하는 것입니다.
중간 필라멘트의 국소화는 음핵을 중심으로 수보로입니다. 악취는 세포 주변으로 올라가는 피 브릴 다발로 핵 영역에 퍼집니다.
중간 필라멘트는 모든 유형의 클리틴에 갇혀 있으며 특히 조용한 클리틴, yakіskhilnі에서 기계적 vplivіv가 풍부합니다. 예를 들어, 표피, m'yazi, 신경 섬유. 로슬린 클리틴에는 중간 필라멘트가 없습니다.
필라멘트 창고 이전에 큰 그룹의 이성질체 단백질이 들어와 chotiri 그룹으로 세분됩니다.
1) 케라틴 섬유. 중합 전 건물의 악취. 그들은 두 가지 하위 유형으로 구성됩니다. 신맛과 중립에 Podіlyayutsya.
2) 중간 엽 조직에 전형적인 Vimentin, Vimentin 섬유. 데스민. 또한 m'yazovoi 조직의 특징이며 매끄럽고 가로로 거무스름합니다. 신경교 단백질은 여러 뉴런의 껍질입니다.
3) 신경필라멘트. 신경 세포의 축삭.
4) 라미나 단백질. 악취는 클리틴의 막하공에서 발견되지 않으나, 나머지 데이터는 일상적인 힘 뒤에 라미나와 중간 필라멘트가 있음을 보여주었다.
모든 산업용 단백질의 경우 유사한 아미노산 서열이 특징적이며 원 섬유의 중앙 부분에 130 개의 초과 아미노산으로 표시되며 나선형 새싹-알파 나선 (모두 동일)을 가질 수 있습니다.
Kіltsevі dilyanki는 나선형으로 표시되지 않는 다른 아미노산 표면, 다른 dovzhina가 특징입니다.
중앙 도메인의 존재는 약 48nm 길이의 이합체인 하위 나선의 생성을 허용합니다. Dimers는 plich-o-plich를 연결합니다. 그들은 4개의 기본 분자를 가지며 vin tetramer라고 하는 짧은 protorfilament를 형성합니다. 두께는 3nm에 가깝습니다. 원형필라멘트는 다시 한 번 쌍으로 도입되고 오래된 얇은 피브릴은 8개의 후기 원형필라멘트(옥타머, 직경 10nm)로부터 형성됩니다. 중간 필라멘트 중합의 모든 특성을 가지고 있습니다.
핵 라미나 단백질, 악취는 어쨌든 중합됩니다. 악취는 머리가 한 지점으로 이합체를 만들고 2로 연마 된 악취는 직사각형 격자가있는 보풀을 형성합니다. 이러한 종류의 성장은 이량체와 관련되어 인산화 반응을 일으켜 통통한 직사각형 격자의 붕괴를 초래합니다. 세포질 중간 필라멘트는 세포 골격의 가장 안정적이고 수명이 긴 요소로 간주됩니다. Tse i є istno 지원 시스템.
Tsikavo는 중간 필라멘트의 확장이 미세소관의 확장을 복제한다는 것입니다. 미세소관이 무너지면 매미가 보인다. 중간 필라멘트의 붕괴. 악취는 핵 주위의 슬릿 다발에서 포착됩니다.
중간 필라멘트의 기능:
1) 당기는 힘에 대한 구조적;
2) 세 가지 클리틴 시스템의 통합: 표면 장치, 핵 세포질.
팟수목 그.세포 골격의 창고에서 우리는 골격 (근위 필라멘트) 및지지 루 코비 (액틴-미오신, 튜 불린-다이네인) 만 세포 골격의 요소를 볼 수 있습니다. 지원 요소에는 두 가지 이동 방법이 있습니다.
1) 미로필라멘트의 주 보석의 건물에 있는 은둔자는 주 빌크 미트루보카 튜블린의 자산을 반 미터로 반 미터로 무료로 만들고 제로 빌키브 플라스민은 학부생입니다.
2) 다른 방식으로, 액틴 또는 튜불린의 피브릴은 특수한 느슨한 단백질인 모터를 움직이는 직접 구조에 의해 전달되었습니다. 악취는 클리틴의 막 및 원섬유 구성 요소와 상호 작용하여 움직임을 요구합니다.
- 실과 같은 단백질 구조의 구조 - 세포의 지지-루호프 시스템을 형성하는 미세소관 및 미세필라멘트.
세포골격은 세포질의 매우 역동적인 시스템입니다. 세포골격의 많은 구조는 쉽게 붕괴 및 재생성되어 형태 또는 형태를 변경할 수 있습니다. 세포골격의 이러한 특징의 기초는 주요 구조적 세포골격 단백질의 중합-해중합 반응 및 구조적 및 조절적 단백질 모두의 다른 단백질과의 상호 작용입니다.
세포골격은 진핵 세포만 될 수 있으며, 원핵 세포(박테리아)에는 아무 것도 없으며, 이는 이 두 유형의 세포 사이의 중요한 차이점입니다. 클리틴싱의 세포골격은 딱딱한 클리틴 벽의 출현을 위해 형성됩니다. Vіn은 amoeboid rush의 기초가되는 세포질 (소위 원형질 오버런)에 ruh organoids를 구성합니다. 세포골격은 클리틴의 모양을 변경할 필요 없이 쉽게 변경할 수 있습니다. 클리틴의 발달은 배아 발달의 초기 단계에서 클리틴 층의 움직임의 형태를 변화시킵니다. 세포 세분화(유사분열)의 경우 세포골격이 "분해"(해리)되고 딸 세포에서는 자체 접힘이 갱신됩니다.
세포 골격의 기능은 다릅니다. Vіn spryaє podtrimtsі는 kіtini, zdіysnyuє 모든 유형 kіtinnyh ruhіv를 형성합니다. 또한 세포 골격은 세포의 대사 활동 조절에 참여할 수 있습니다.
단백질 탐닉의 세포골격. 세포골격에서 전자현미경 연구 중에 기억되는 주요 구조 요소 뒤(미세필라멘트, 중간 필라멘트, 미세소관) 또는 창고로 들어가는 주요 단백질(액틴 -미오신, 튜불린-네불린- ) ).
중간 필라멘트접힘, 역학 및 기능에 대한 세포 골격의 주요 구성 요소 중에서 가장 합리적인 구조입니다. 그들의 힘과 역학은 미세소관과 액틴 필라멘트의 특성에 크게 영향을 받습니다. dos의 중간 필라멘트의 기능은 가설의 영역에 남겨집니다.
세포질 중간 필라멘트는 척추 및 척추가 없는 생물체와 더 큰 로슬린 모두에서 가장 중요한 수의 진핵 세포 클리틴에서 밝혀졌습니다. 클리틴 생물을 엄격하게 적용하십시오. 뒤에 남을 수없는 중간 필라멘트가 표시되지 않으면 중간 필라멘트의 단백질 파편이 비 기본 구조를 형성 할 수 있습니다.
형태학적 미세소관벽 두께가 약 5nm이고 직경이 약 25nm 인 빈 실린더. 원통의 벽은 프로토필라멘트로 구성되어 있습니다. protofilament의 미세 소관 창고에서 uzdovzh їх dovgoї osі의 작은 손상이 일대일로 이동하므로 tubulin subunit utvoryut three-start helix. 13개의 원형 필라멘트는 대부분의 생물의 미세소관 창고에 포함되어 있습니다.
액틴 필라멘트 m'yazovyh 및 비언어적 클리틴의 빠르게 움직이는 장치에서 중요한 역할을 하며 또한 취약성, 클리틴 형태의 유지, 세포질분열과 같은 풍부한 기타 클리틴 프로세스에 참여합니다.
액틴 필라멘트 또는 원섬유 액틴(F-액틴)은 직경이 6-8nm인 얇은 원섬유입니다. 악취는 구형 액틴-G-액틴의 중합 결과입니다. 세포에서 액틴 필라멘트는 다른 단백질의 도움을 받아 비인격적인 다른 구조를 형성할 수 있습니다.