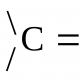Смесване на два газа с различни температури. Zmіshuvannya gazіv. Основи на химичната термодинамика
13.7. Термични трансформатори
По-голямата част от технологичния процес е необходимо да се поддържа същата температура.
Най-простият начин за този вид охлаждане е чрез изгаряне на огъня и пренос на топлина от горещи продукти на горене, или без средна топлина, или междинна топлина. При което топлообменът се осъществява по естествен път в посока на горещ джерел с температура T 1 студено с температура T 2. При този метод има повече топлина, по-ниско отримане при изгаряне на огън, невъзможно е да се прехвърли (и връзката с разходите е много по-малка).
Все пак по принцип е възможно, очертавайки се за деак много топлина р" за висока температура T 1, извадете повече топлина при по-ниски температури, без да използвате работа T 2. За което е достатъчно да се създаде обратен директен цикъл на Карно между високотемпературна и високотемпературна среда T ч, в резултат на което ще бъдат отведени до робота (div. (7.7)):
Vitrativshi tsyu работи при обратния обратен цикъл на Карно между средата с температура T чи спокойна с температурата T 2, ние ще прехвърлим на останалите количеството топлина, което е здравословно
Замествайки в този контекст значението на роботите л чот предната virazu, ние вземаме:

de коефициент на пропорционалност ψ 1.2 се нарича коефициент на преобразуване на топлинатаспоред температурата T 1 до температура T 2 .
Otzhe, otrimavshi р" Количеството топлина от джерела с температура T 1 може да се предаде на тялото с температура T 2 количество топлина ψ 1.2 р" .
така як T 2 T 1 , тогава i р" >р" .
Например, нека T 1 = 1000 за Z, T 2 = 50 pro Z, T ч = 0 около С. Коеф. По този начин, за да се отнеме например 5 J топлина при температура 50 о С, трябва да е по-малко от 1 J топлина при 1000 о С, докато в случай на инсталация за първично обгаряне 1 J от топлината при висока температура трябва да премине в такова количество топлина при ниска температура.
Също така, с поглед на термодинамиката, инсталацията с опал е 5 пъти по-икономична, по-ниска инсталация за обратен топлопренос.
Приставката, която позволява директни и обратни цикли на пренос на топлина от джерела със същата температура към по-ниска температура, се нарича термотрансформатор.
Ако се изисква по-ниска температура за уикенда, тогава се извиква термотрансформаторът понижаване.
За понижаване на висока температура, слаб вятър, се нуждаете от допълнителна помощ ходтермотрансформатор, за някои, така че T 2 > T 1 .
Ориз. 13.7 Малък 13.8
Термотрансформатор за термодвигател и термопомпа.
На фиг. 13.7 показва диаграма на понижаващ термичен трансформатор, а на фиг. 13.8 - його теоретичен цикъл.
На фиг. 13.9 е показана схема на термотрансформатор, който се движи, а на фиг. 13.10 - йога теоретичен цикъл.
На фигурите: І - термичен двигател, ІІ - термопомпа.
Като термотрансформатор на назначения за поддържане на температури ниски, и по-високи, по-ниска мощност, vin се нарича смесен тип термотрансформатор.
Ориз. 13.9 Малък. 13.10
Контролирайте храненето
Как работи цикълът на обръщане на Карно?
Какъв параметър оценява термодинамичната ефективност на термопомпената инсталация?
Кои са важните схеми на термопомпените и хладилните агрегати?
14. Смяна на газ и пара
В различни стопански постройки майките често се отвеждат вдясно чрез zmіshuvannyam на различни газове, пара и въздух. В този случай е необходимо да се обозначат параметрите ще стана сумата за дадените параметри ще стана компонентите, които ще определят сумата на сумата.
Изпълнението на тази задача е в умовете, за които е създаден този процес на промяна. Всички начини за приготвяне на суми могат да бъдат разделени на три групи:
zmіshuvannya gazіv при постоянни obsyazі,
смесване на газови потоци,
zmіshuvannya gazіv pіd час zapovnennya резервоар.
14.1. Процесът на промяна на поста
Какъв е начинът сборът от сумите да се крие във факта, че пръскане на газ от менгемето Р 1 , Р 2 , …, Р н, температури T 1 , T 2 , …, T нта масами Ж 1 , Ж 2 , …, Ж нзаемат различни задължения V 1 , V 2 , …, V н(фиг. 14.1).
Ако подредите преградите, които ще се разпространяват между газове, тогава ще има смес от газове,
V = V 1 + V 2 + …+ V н ,
и много луди
Ж = Ж 1 + Ж 2 + …+ Ж н .
С инсталирането на еднакво важна, параметрите на сумата ще бъдат Р, v, T, u.
Ако адиабатичният процес не се промени, тогава вътрешната енергия на системата се запазва в първия кочан на термодинамиката:
U = U 1 + U 2 + …+ U нили Gu=G 1 u 1 + Ж 2 u 2 + … + Ж н u н .
Вътрешната енергия на домашния любимец се измерва, както следва:
![]() , (14.1)
, (14.1)
де ж аз- масова част азта газ.
И домашният любимец се съгласи за назначаването му
![]() . (14.2)
. (14.2)
Други параметри ( Р, T) за реални газове parіv и rídin се намират в диаграмите за тези речи.
В хладно настроение, ако се смесят идеални газове с постоянен топлинен капацитет, за тези ду= ° С v dT, взета
 В този случай, ако части от един и същ газ се колебаят, температурата на сумата се изчислява с помощта на по-проста формула:
В този случай, ако части от един и същ газ се колебаят, температурата на сумата се изчислява с помощта на по-проста формула:
![]() .
.
Налягането на газта след смяната се начислява по равните на Клайперон-Менделиев
де Р- газът стана сумиши (обозначен в раздел 1.4).
14.2. Процесът на смесване на потоци
По този начин флуктуацията на газовете възниква в резултат на натрупването на много потоци в един канал.
Нека тръбопроводът 1 (фиг. 14.2) към смесителната камера трябва да се подаде газ с параметри стр 1 , v 1 , T 1 , ч 1 , и през тръбопровода 2 – газ с параметри стр 2 , v 2 , T 2 , ч 2 .
Витрата газ през тръбопровод 1 dorivnyuє Ж 1, чрез тръбопровод 2 – Ж 2. На входа на камерата смесването и газовите потоци се дроселират, за да се притисне камерата Р bulo по-малко, по-ниско Р 1 та Р 2 (yakby, например, Р > Р 1, тогава газът от камерата ще се втурне към тръбопровода 1 ).
Следващ глас, какъв порок Рв камерата вентилацията може да се регулира по различен начин (регулиране на клапаните); Процесът на флуктуации в тока е абсолютно същият като флуктуациите в стационарно състояние, детискът се характеризира уникално с параметрите на газовете, които се колебаят.
От камери за смесване на газ с параметри Р,v, Tтръбопровод 3 . Витрата газ в тръбопровода 3 , очевидно, dorivnyuє Ж = Ж 1 + Ж 2 .
Разпръснатият газ по тръбопроводите се срутва, след това krím vnutrishnyoї energії, vіn maє (yak tіle) sche и кинетична и потенциална енергия. В името на простотата (вярно е за повече технически проблеми), важно е това
хоризонтално roztashovan тръбопроводи, zm_noy потенциална енергия може да бъде znehtuvat;
скоростта на движение на газ трябва да бъде малка, tobto. промяна на кинетичната енергия също е nechtuyemo.
Същото нещо с първия кочан за адиабатен поток (9.3)
Zvіdsi otrimaêmo viraz за домашни любимци enthalpії sumíshi, otrimana в резултат на zmіshuvannya в потта:
![]() . (14.3)
. (14.3)
Познаване на енталпията на вашия домашен любимец чтова менгеме Рслед смяна на газта, за допълнителни диаграми ще мога да знам и други параметри на сумата ( T, v, си в.).
За идеални газове, замествайки тази енталпия с вираз ч Р T, взета
![]() . (14.4)
. (14.4)
По време на смесване на два потока от един газ, формулата за температурата на сумата ще бъде проста:
![]() . (14.5)
. (14.5)
Познавайки температурата в такъв ранг T, ще стана равен за идеален газ, можете да знаете дребния обсяг:
Формули (14.3)–(14.5) се записват по подобен начин за определен брой газови потоци, които се колебаят.
14.3. Спомен по време на задължението
Отидете до резервоара 1 (фиг. 14.3) Vе газ (пара, родина) Ж 1 с параметри Р 1 , Tедин . Чия цистерна има тръбопровод 2 газ из параметри Р 2 , v 2 , T 2 (очевидно какво Р 2 > Р 1) че по маса Ж 2, след което вентилът се затваря. В резервоара излиза пълно количество газ Vче масою Ж = Ж 1 + Ж 2. Необходимо е да се уточнят параметрите на взетата сума.
В процеса на пълнене робот се монтира над газа в тръбопровода 2 , ривна – стр 2 v 2 Ж 2; в резервоара няма робот, фрагментите са фиксирани към резервоара.
В адиабатичния процес на робота е необходимо да се промени вътрешната енергия за баланса (както преди, кинетичната енергия на газа, който тече, невъзможно е да се погледне липсата на течливост на потока):
Вътрешната енергия на домашния любимец Zvіdsi в съда е здрава
![]()
Питома много суми за пари v = V/ Ж.
знаейки uі v, за допълнителни диаграми знайте други параметри sumishi ( Р, T, с, ч).
В момента на смесване на един и същ идеален газ с постоянни топлинни мощности
де к- Индикатор за адиабати.
Порок на резервоара
Две порции се смесват последователно, освен това теглото на първия компонент е 10 kg, температурата е 400 ° C, а масата на другия компонент е 90 kg, а температурата е 100 ° C.
Решение: сумарна температура в резултат на флуктуационния процес в случай на постоянна вентилация или флуктуационният процес в газовия поток зависи от формулата T = ж 1 T 1 +ж 2 T 2. І в нашето приложение е по-скъпо T\u003d 0,1 ∙ 400 + 0,9 ∙ 100 \u003d 130 про С.
Ако се сумира като резултат от ангажимента, при който първият газ вече е известен, тогава абсолютната температура се изчислява по формулата T = ж 1 T 1 +килограма 2 T 2. Този приклад отново има дисплей на адиабати к= 1,4 T\u003d 0,1 (400 +273) +1,4 ∙ 0,9 ∙ (100 +273) - 273 \u003d 264 около С.
14.4. Промяна на ентропията при промяна
Ентропията на sumish е сумата от ентропията на склада qiu sumish, tobto.
но в домашни размери
Тъй като процесът на промяна е необратим процес, тогава ентропията на една термодинамична система (всичко в адиабатна промяна на речта) е подобна на друг кочан на термодинамиката в процеса, ако расте, tobto.
Необратимостта на процеса на смесване се обяснява с дифузията на компонентите на смесването, които съпътстват процеса. Увеличаването на ентропията в процеса на промяна в света на необратимостта.
Контролирайте храненето
Какви са основните начини за смесване?
Какви са начините за получаване на сумаш?
Как да изчислим сумарната температура за различни методи на смесване?
Как можете да обясните защо при адиабатична флуктуация на газа сумата на ентропията ще се увеличи?
15. Основи на химичната термодинамика
Хетерогенната система се характеризира със склад на нейните компоненти. За пеещите умове този склад може да бъде променен за флуктуациите на химичните и физико-химичните трансформации, които се въвеждат в системата, с които се разрушават старите и се образуват нови връзки между атомите. Тези процеси са придружени от видения на чи слята енергия в резултат на ди силите на тези връзки.
Химическата термодинамика разглежда развитието на първия и другия кочан на термодинамиката към химични и физични и химични явления.
15.1. Химична реакция
Химическа реч- tse макроскопично тяло на химическия склад, tobto. tіlo, schodo такова нещо не е само, от такива химични елементи, че в такива пропорции се добавя ( индивидуална химическа реч); сумашили розчин).
Химическата реч (рафт) се характеризира с химическа формула, която показва от кои елементи се образува и в кои атоми на тези елементи се образуват за нейното приемане.
Процесите на взаимовръзки между отделните химически речи, които водят до създаването на нови речи, се наричат химична реакция.
Независимо дали е химическа реакция, тя може да се види както в права, така и в обратна посока.
В затворени системи химичните реакции се наблюдават по такъв начин, че количеството на химическите елементи на кожата, налични в системата, не се променя. За причините, поради които химичните реакции не участват достатъчно речи, но стехиометрични величини, тогава. kílkostі, scho vіdpovіdat химически формули речи. Следователно химичните реакции се записват като равенства между химичните формули на речевите реакции и химичните формули на реакционните продукти. Хайде НО 1 , НО 2 , …, НО н- изходни речи и AT 1 , AT 2 , …, AT м- Kíntsev продукти на реакциите. Същата химическа реакция между речите НО 1 , НО 2 , …, НО н, който се обади до края на изказванията AT 1 , AT 2 , …, AT м, регистрирайте се при вида на невъзмутимост:
в Yakomu α 1 , α 2 , … α н, β 1 , β 2 … β м- Стехиометрични коефициенти. Например, в резултат на изгаряне на метан, въглероден диоксид и вода се разтварят:
CH 4 + 2O 2 \u003d CO 2 + 2H2O.
За едно количество реч по химия се приема 1 мили В това количество има определен брой молекули (атоми) на тази реч, която е по-стара от Авогадро н А= 6,02204∙10 23 . С други думи: 1 мол реч се счита за такова количество реч, чиято маса в грамове е най-скъпата молекулярна (атомна) маса на М.
склад на сгъваеми системи н азбенки, пита химията моларни частисистемен компонент.
1. Смесване на газове при V=const. По този начин общият обем, заемащ газове до и след промяната, се запълва с константа и газ до промяната, заема обеми V 1, V 2, ... .. V n m 3 при порок p 1, p 2, p n і температури T 1 T n , и промяната в топлинния капацитет на тези газове s r / s v добавете k 1 , k 2 ,…. k n
температура
заместник
 (5.15)
(5.15)
За газове, за които моларните топлинни мощности са равни, а също и равни стойности на k, формулите (62) и (63) изглеждат така:
2. Промяна на газовите потоци. Колко маси на vitrati потоци, които се колебаят, са равни M 1, M 2, ... M n, kg / година, обем на vitrati - V 1, V 2, ..... V n m 3 / година, заместник газ - р 1 , р 2 , р n і температури - Т 1, Т 2, ... Т n, и ако сините топлинни мощности на другите газове са равни k 1, k 2, .... k n тогава общите температури се определят по формулата:
 (5.18)
(5.18)
Обемът на сумата на изразходваното количество за един час при температура T и обратно:
 (5.19)
(5.19)
За газове, ако са известни стойностите на k равни, сумарната температура се определя по формула (64). Ако газовите потоци със същата стойност на k са в затруднение, тогава формулите (66) и (67) изглеждат така:
 (5.21)
(5.21)
мениджър
5.1. Да се знае промяната във вътрешната енергия от 1 kg отново по време на прехода на 1-ва мелница за кочани t 1 \u003d 300 0 С към крайната при t 2 \u003d 50 0 С. Моля, дайте дата в kJ.
Промяната във вътрешната енергия е известна с формулата (5.9):
Du \u003d W vm (t 2 -t 1).
Използвайки раздела. 4.3, изисква се за преглед
(Z vm) 0 t =0,7084+0,00009349t kJ/(kg K);
(3 vm) 50300 = 0,7084 +0,00009349 (50 +300) = 0,7411 kJ / (kg K).
Отже,
Du = 0,7411 (50-300) = - 185,3 kJ / kg
Vidpovid: DU = - 185,3 kJ/kg
5.2. Познайте отново промяната във вътрешната енергия 2 m 3, така че температурата й да намалява при t 1 \u003d 250 0 С до t 2 \u003d 70 0 С. Кочанът отново P1 = 0,6 MPa.
Vidpovid: DU = -1063 kJ.
5.3. Към газа, поставен в цилиндъра с движение на буталото, се извикват 100 kJ топлина. Стойността на vikonan работа при tsimu става 115 kJ. Значително се променя вътрешната енергия на газа, в резултат на което разходът е 0,8 кг.
Vidpovid: DU = - 18,2 kJ.
5.4. 2 m 3 повторения при налягане 0,5 MPa и температура 50 0 C се променят от 10 m 3 повторения при налягане 0,2 MPa и температура 100 0 C. Задайте налягането и общата температура.
Видповид: t cm = 820С; Р cm = 0,25 MPa.
5.5. На избрания газоотвод на котелната централа пърхат газовете от три котела, кой да отиде, кой да натисне атмосферното налягане. За по-голяма простота се приема, че един и същи газ може да има един и същ склад, самият той: CO 2 = 11,8%; 02 = 6,8%; N2 = 75,6%; H2O=5,8%. Vartov vitrati gasіv за установяване на V 1 \u003d 7100 m 3 / година; V 2 \u003d 2600 m3 / година; V 3 \u003d 11200 m 3 / година, а температурата на газовете се вентилира t 1 \u003d 170 0 С, t 2 \u003d 220 0 С, t 3 = 120 0 С. температура.
Vidpod: t = 147 0; V \u003d 20 900 m 3 / година.
5.6. Газовете, които отиват, от три парни котли при налягане от 0,1 MPa се движат в избрания газопровод и през димоотвода се изпускат в атмосферата. Обемен склад на газове, какво да отида, от следващите котли на атаки:
С02 = 10.4%; Pro 2 = 7,2%; N2 = 77.0%; Н20=5,4%;
от друг
С02 = 11,8%; 02 = 6,9%; N2 = 75,6%; Н20=5,8%;
трети
CO2 = 12,0%; 02 = 4,1%; N2 = 77,8%; H2O=6,1%.
Vartovі vitrati gazіv пъти
M 1 \u003d 12000 kg / година; M 2 \u003d 6500 kg / година; M 3 \u003d 8400 kg / година; и температурата на газа обикновено е t1 = 1300C; t 2 \u003d 1800C; t 3 \u003d 2000С.
Определете температурата на газовете след смяната на избрания газопровод. Приемете, че моларният топлинен капацитет на тези газове е еднакъв.
Vidpovid: t 2 \u003d 164 0 Z.
5.7. В газопровода има три газови потока, които създават едно и също налягане, което е 0,2 MPa. Първият поток е азот с обем V 1 = 8200 m 3 / година при температура 200 0 C, другият поток е въглероден диоксид с 7600 m 3 / година при температура 500 0 C и третият съд - повторете с vitrata 6400 m 3 / година при температура 800 0 С.
Vidpod: t 1 = 423 0; V=23000 m3/год.
5.8. Продуктите от горенето от газопровода на парния котел в количество 400 kg/годишно при температура 900 0 С поради охлаждане до 500 0 С и направо в сушилнята. Газовете се охлаждат чрез смесване на газовия поток с потока отново при температура 20 0 C. Налягането в двата газови потока е еднакво. Изчислете годината vitrata всеки път, тъй като е известно, че R газ = R rev. Топлинният капацитет на продуктите от горенето трябва да се вземе равномерно.
Предложение: M turn. = 366 кг/год.
Оставете го в няколко термостатични съда под същото налягане стр Гази НОі ATприемани в количества емоли. При натоварването на тези кораби ще има имитация на газовете, докато се инсталира единно газово хранилище според цялата система. Да приемем, че изходът на газовете и техните суми ще бъдат равни на идеалните газове. Тоди за запазване на постоянното газово налягане стр парциалното налягане на газовете в сумата, какво да се утаи, ще бъде равно
При промяна на идеалните газове в топлинните ефекти през деня, топлообменът между газовете и термостата не се контролира и промяната в ентропията на системата е по-вероятно да означава необратимост на процесите в средата на системата.
За да се знае промяната в ентропията, е необходимо да се сравни описаният процес на мимикрия с ясен преход между същите кочани и крайни мелници на системата.
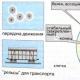
За също толкова важна промяна в газовете, тя се ускорява от специална хипотетична приставка, по аналогия с термостата, която се нарича хемостат. . Тази приставка е сгъната от термостатичен цилиндър, движещ се без триене от бутало; в основата на цилиндъра има мембрана, която е вибриращо проникваща за тази индивидуална химическа реч; остават в трупоизгарянето на индивидуална реч, загружене в хемостат, в сбора на речи, които са усукани, които се намират в друг съд. С помощта на термостата, предназначен за поддържане на зададената температура на затопляне в тялото му, или за нагряване или охлаждане на постоянен в равнинни режими, с помощта на хемостата се осигурява поддържане на определено значение на химическия потенциал на дадено индивидуално изпитвано вещество от сместа, а също и равномерно подвеждане и отвеждане на продукта от сместа . Химически потенциал аз -хохимичният компонент на хемостата е недвусмислено показан от температурата Tи с менгеме създаваме върху буталата. Чрез промяна на налягането върху буталата можете директно да промените прехода на този компонент през селективната мембрана: ако химическият потенциал на компонента е в последната сума, тогава когато речта ще бъде добавена към сумата, когато - ще бъде показано от сумата, и когато хемостатът се смеси. Kvazirivnovaga променя сумата на сумите в случай на дифузно прехвърляне на реч през мембраната при малка разлика в стойността на химическия потенциал по протежение на страните на мембраната.
Химическият потенциал на идеален газ, независимо дали газът е известен в отделна станция или в смес с други идеални газове, се изразява просто чрез разликите, де стр азє или налягането на чист газ, или иначе парциалното налягане на сумата. Следователно, когато идеален газ се прехвърля през мембраната, той е еднакво проникващ между сумата и хемостатът се характеризира с еднакво налягане в хемостата и парциалното налягане на газа в сумата.

Ориз. 2.3. Също толкова важно е смесването на два газа за допълнителни хемостати: а- Система за мелница за кочани; b- Мелнична система за изотермично разширение на газове; в- Kіntsevy stan след zmіshuvannya gazіv през мембрани; 1 – хемостати на отделни газове А и Б ; 2 – напівпроникни мембрани; 3 - Съд за също толкова важно смесване на газове.
Също толкова важно е смесването на идеални газове Аі бизвършва се в термостатна система, която се състои от два хемостата и отделни компоненти Аі б, с третия съд - сумата от сумите, които утаяваме, ще обезопасим, също като хемостат, с бутащо бутало (фиг. 2.3).
Нека моментът на кочана в хемостатите да бъде елиминиран под формата на молове на компонента Атози мол компонент бпод същото менгеме стр
; буталото при избора на сумиши е в нулева позиция (газът под буталото достига нула). Процесът на смесване се извършва на два етапа. На първия етап е необходимо да се промени изотермичното разширение на газовете. Аі б; при натискане Анамали гледката стр
до предварително определен порок и порок б vіdpovіdno vіd стр
преди. Obsyagi, scho zamayutsya газове в първия и в другите хемостати, промяна vídpovіdno víd to і іd to . Един робот, порочен от газ, който се разширява, в първия хемостат, е по-скъп ![]() ; на друг
; на друг ![]() . Така на първия етап в нашия хипотетичен анекс се извършва цялостна работа. Парчетата с изотермично разширение на идеален газ със същата вътрешна енергия не се променят; Zvídsi договорима промяна на ентропията в системата ще бъде равна
. Така на първия етап в нашия хипотетичен анекс се извършва цялостна работа. Парчетата с изотермично разширение на идеален газ със същата вътрешна енергия не се променят; Zvídsi договорима промяна на ентропията в системата ще бъде равна
В другия етап на процеса (смесване на въздуха), газовете от хемостатите се пропускат строго през селективните мембрани в обобщенията на трите бутала, синхронизирани от потока. В същото време върху кожните бутала се прилага постоянно налягане, очевидно и в хемостатите, и в колекцията, което осигурява равномерното преминаване на газовете през мембраните (по-точно, налягането на колекцията е по-малко. стр , Запазване на влиянието на нула върху разрушителната сила на дифузия през мембраната). Обратното на процеса на смяна в случая се осигурява от възможността за синхронна смяна на въртенето и на трите бутала директно, което би довело до адски много объркване на отделни компоненти. След приключване на операцията, обобщете, очевидно, заема от колекцията от томове.
Парчетата от различни идеални газове не се влияят от никакъв топлинен ефект, топлообменът на нашето приложение с термостат на друг етап от операцията през деня. Отже, промяната на ентропията на системата не е възможна, .
Corisno пресича пътя на директен pídrahunk, scho газовият робот на друг етап ще достигне нула. Вярно е, че се използва робот, който задвижва буталата в хемостатите, като в същото време газовете се извеждат в колектора от същия размер на робота. Zvіdsi.
Също така, общото увеличение на ентропията в случай на флуктуиращи газове се определя от viraz (2.9), . Дори при еднакво важен вариант на промяната, увеличаването на броя на връзките поради връщането на топлината и променливостта на еквивалентното количество работа ![]() , тогава при директно (необратимо) преместване на газове, същото увеличение на ентропията се задвижва от потока на генериране в средата на системата; няма роботизирана система с кого да не ограбиш.
, тогава при директно (необратимо) преместване на газове, същото увеличение на ентропията се задвижва от потока на генериране в средата на системата; няма роботизирана система с кого да не ограбиш.
След замяната (2.8) и viraz (2.9) могат да бъдат пренаписани като
 . (2.10)
. (2.10)
Към какво spіvvіdnoshenyu vídvoditsya obov'yazkové místse в курсовете на термодинамиката чрез йога на парадоксалността. Трябва да се отбележи, че промяната в ентропията (при промяна на идеалните газове!) не е от значение, което се променя от нея и вятъра при такова налягане и температура. Всъщност тук се въвежда неформален висновок (2.10).
Добавен visnovok (2.10) с його кафяви надписи. Представяне на моларните части на компонентите ![]() и вземаме вираз, за да променим ентропията в rozrahunka за 1 мол сума, която се урежда:
и вземаме вираз, за да променим ентропията в rozrahunka за 1 мол сума, която се урежда:
![]() . (2.11)
. (2.11)
Максималната стойност на функцията зависи от еквимоларната сума на газовете, 0,5.
От гледна точка на теорията, при сумирането на изказванията, е лесно да се промени ентропийната вибрация, като се добавят голям брой молове от компонента бдо един благословителен компонент А. Като се има предвид (2.10) i , вземаме
Когато беше показано (2.12), математическото представяне на логаритмичната функция
 .
.
Формула (2.12) показва, че последното разширение на сумата е придружено от неизчерпаемо нарастване на ентропията на разширението на мол от компонента на къщата.
Формула (2.10) дава интегралната стойност на нарастването на ентропията при промяна на крайните количества газ. За да се стигне до компактно диференциално решение, подобно на формула (2.7) за пренос на топлина, моделът на смесване на компонентите (разд. Фиг. 2.4) е модифициран. Допустимо е сместа да се вкарва през мембраната, която е пропусклива и за двата компонента, или през тесния клапан, който разделя съдиите, пълни със суми. Аі бсклад. Системата е термостатно управлявана и в двата съда има постоянно налягане зад спомагателните бутала стр . В случай на размяна на шведски, съхранението на сумиши в кожата на съдилищата може да бъде взето от съдилищата по същия ред. По този начин дадената система е подобна на топлообменната система със слабо проводима преграда.
Да се посмеем н химически неинтерактивен сред тях идеален газ Да продължим, че с помощта на термодинамичните параметри ще стана всички компоненти до промяната и промяната на ума (разумът в комбинация с необходимата среда). Трябва да знам еднакво важно параметрите ще станат газ след промяната
Нека разгледаме два начина за промяна, за простота, нека вземем предвид какъв е процесът без топлообмен с необходимата среда .
2.1. Zmіshuvannya при W=конст
В това настроение измийте ума си така, че да се объркате, да се успокоите Увижте общата сума на сумите на кочана W H i:
(Нито следа от бездомник W H iс частични задължения Wi, разгледано в параграф 1.4.3.)
Значително:
P H i- Менгеме за кочан аз-ти газ;
T H i,t H i- Початкова температура аз-тият газ е подходящ за до 0 Предиили 0 У.
защото цялата система нгазове с zmíshuvanni в умовете W=констне zdіysnyuє zvnіshnії ї raboty, тогава е възможно да запишете до първия кочан на термодинамиката за първата вълна () можете да напишете:
Тук: U cm - вътрешна енергийна сумарна газова маса мсм кг
с температура Т 0 К;
U H i- вътрешна енергия азта газова маса m iкилограми
с температура на пъпките T H i .
Нека въведем обозначението:
u cm - доставка на вътрешна енергия на сумата от газове при нормални температури Т 0 К;
u H i -вътрешна енергия на домашен любимец аз-ти газ с температура на кочана T H i .
Todi изравняването (2.1.1) изглежда така:
(2.1.2)
Както се вижда, за идеален газ du=C v dT zvіdki at vіdlіku vіdlіku vіdlіshnyої ї vіd 0 0 Предиможеш да пишеш:
Тук: - Средно в диапазона 0 Т 0 Кмасов изохоричен топлинен капацитет на сумарните газове;
Средно в диапазона 0 T H i 0 Kмасов изохоричен топлинен капацитет азта газ.
След заместване (2.1.3) (2.1.2) вземаме:
Въпреки това до параграф 1.4.10 масовият топлинен капацитет на общите газове се изразява чрез масовите фракции на компонентите giи правилния им топлинен капацитет в следващия ред:
Подобно на средното в диапазона 0 Т 0 Кмасовият изохоричен топлинен капацитет на сумата от газове се означава като:
Замествайки тази вираза с лявата част на уравнението (2.1.4), вземаме:
звезди (2.1.5)
защото Ще стана равен, тогава след смяната m iдокато се изравни (2.1.5) пак приемаме формулата за сумарна температура нгаз:
Както можете да видите, формула (2.1.6) може да бъде написана по обиден начин:
(Следващото предположение какво tvir е средното в диапазона 0- T H i 0 Kкътник изохорен топлинен капацитет азти газ.)
В напредналата литература често се дават емпирични депозити на топлинен капацитет при температури за диапазона 0 t 0 С .
След заместване (2.1.8) и (2.1.9) до равенство (2.1.2), вземаме:
Замяна m iЗа тези стойности формулата за общата температура на газа в градуси Целзий :
Висловлючи R iчрез молекулното тегло изваждаме още една формула:
При знаците на формули (2.1.6), (2.1.7), (2.1.10) и (2.1.11) се измерва средният топлинен капацитет, за който горната граница се осреднява със сумарната температура ( Tили T), каква е целта на назначаването. Поради това сумарната температура се определя по тези формули метод на последния подход .
2.1.1. Частни колебания на газовите колебания при W=конст
Нека да разгледаме няколко примера за формули (2.1.6), (2.1.7), (2.1.10) и (2.1.11).
1. Не позволявайте на газите да реват, защото някои угари показват адиабати до iтемпературата може да се променя.
(Наистина ли Предисе променя с повишаване на температурата, т.е.
де боклуци , а- Емпирично положителни коефициенти.
За технически rozrahunkiv в диапазона от 0 до 2000 0 C може да се изчисли по следните формули:
а) за двуатомни газове Преди 1,40 - 0,50 10 -4 T;
б) за продукти от горенето Преди 1,35 - 0,55 10 -4 T.
От списъка с формули може да се види, че след инжектиране на температурата в дисплея на адиабати Предистава по-малко забележим при температури, близки до стотици градуси под скалата на Целзий.
Така че, yakscho пусна, шо
след това формулата (2.1.6) за обиден вид:
Формула (2.1.12) може да бъде печеливша като първо приближение за формули (2.1.6), (2.1.7), (2.1.10) и (2.1.11)
2. Оставете газовете да се колебаят, за които топлинните мощности на мълния и изорог са равни и натрупването на тези топлинни мощности може да бъде повлияно от температурата, така че:
Тоди изравняването (2.1.7) изглежда като просто:
Тъй като газовете имат еднакъв моларен и изохоричен топлинен капацитет, тогава е вероятно той да бъде равен на Майер
поради buti равни помежду си и на малък изобарен топлинен капацитет, както и равни показания на adiabati, tobto.
С вашия ум равно (2.1.12) се трансформира в (2.1.13).
2.1.2. Тиск след колебанието на газовете при W=конст
Налягането, което се възстановява след колебанието на газовете, може да се определи или по формулите на параграф 1.4.2, или по ума:
Рсм У cm = мсм Рсм T= мсм T.
Можем ясно да видим три хоризонтални топки A, B и C на нашата бензиностанция, освен това топката на разширение е по-голяма от A, а A е по-висока от C. топка B. Назад, бъдете като много суми в склад A може да се разпредели на две суми в складове и C.
Tse zmíshuvannya, че podíl dvoh gazіv може да бъде zdíysniti и обратен начин, zmіtsnivshi в A, B и C хоризонтални тромпети. Този край на такава кожна тръба, която излиза от бензиностанцията на името, се затваря с бутало. Нека сега поставим буталата в средата на топките B и C, като ги избутаме, да речем, ядосани надясно, а в точка А, от друга страна, ще извикаме буталото надясно, след това надясно . Todi B и C deyakí masi gas pídut zí stovpa, и A, navpaki, nadіyde yakіs obsyag sumíshi. Приемаме, че в такава скин-тръба има дебела маса от същия склад, който представлява хоризонтална топка от газова колона, с която се дава тръба, за да се напомни.
![]()
Значение за приписване на същото от ривнян
Вижте какво следва
![]()
Сега нека разделим сумата като върколак и развеселим опетнения робот.
Въведено в А само obyagu sumishi, и z i vevemo, vіdpovіdno, obyagi
Цялата работа, опетнена от процеса, е скъпа
Като заместим тази стойност, Бачимо, този робот е равен на нула.
Тук има двойка финес: сумиши и на яките сумиш А се разпадна, вдигна се на височината на височината и придбали, в такъв ранг, силата на енергията. Но ако роботът достигне нула и температурата на системата е постоянна, в този случай може да е по-малко, тъй като системата ще отдава или отнема много топлина. Знаейки промяната в потенциалната енергия, ние знаем количеството топлина, системата е подобрена, както и звездите и промяната в ентропията.
Увеличаване на потенциалната енергия в склада
но е по-скъпо да добавите топлина към системата, така че увеличението на ентропията да бъде едно
За такава стойност на сумата от ентропийната обща сума и общата сума C е по-голяма от ентропийната единица обща сума A. Възможно е да се знае общата сума на сумата B и C, сумата на ентропията на такава по-ентропийна единица обща сума А; за които е възможно да се приведат общите суми B и Z по обратен изотермичен начин до сумата, увеличението на ентропиите на двете суми, в който процес е равно на виразата (75), взета с обратен знак.
Увеличение на ентропията за общия запас
![]()
![]()
Представя се в изравняване (76) вираз за плътност през междината