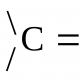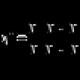Molekularni raspon. Spektri kofuzije dvoatomskih molekula Hemija kofuzionih spektra elementa
tipi kolivani
Energija potrebna da se uništi cijepanje atoma u molekuli, utječući na energiju svjetlosnih kvanta sa dugim perom od 1-15 mikrona, ili s brojem pera od 400 ÷ 4000 cm -1, zatim elektromagnetna vibracija srednjeg infracrvenog region. Kolizija je jednaka molekulima kvantizacije, energija prelaza između njih i, takođe, frekvencije kolavacije mogu biti od manjeg značaja. Kako kvant svjetlosti blijedi, molekul može prijeći preko višeg prstena dimnjaka, zvučeći iz glavnog kolivalnog kampa zbudženije. Energija gline se zatim prenosi na revitalizaciju vanjskih slojeva, ili se pretvara u kinetičku energiju molekula. Fuzija molekula je uočena u dva tipa spektra: spektri odsjaja u infracrvenom području (IC-spektri) i spektri kombinatorne difuzije svjetlosti (Ramanovi spektri).
Matematički model fuzije bogatih atomskih molekula je sklopiv. Analiza je provedena samo za najjednostavnije dvoatomske molekule. Kolivalna spektroskopija može imati prenaglašen empirijski karakter, tobto. glavne frekvencije colivinga su oduzete od performansi spektra bogatih spoluka iste klase. Tse, međutim, ne primjenjuje vrijednost metode.
Glavne vrste kolivinga su valentnost i deformacija.
Valentine kolivacija se naziva kolivanija jezgara atoma u zračnim linijama veze, smrad se označava slovom n (nC=C, nC=O i sl.).
Približni mehanički model valentnih kolivana može biti sistem od dva namotaja vezana čvrstom oprugom (ovde zavojnice predstavljaju atome, a opruga je hemijska veza) (div. sl., a).
A, B - valentna kohezija u molekulima;
C - deformacija colivanna: I, II - makaze; III, IV - klatna; V - vialoví; VI - torzijski.
Kada se rastegne, pritisak opruge, hladnjaka, počinje da se klati oko položaja jednakog, tako da će nastati skladan coli, koji se opisuje jednakim

de n - Učestalost grčeva; F - snaga je brza, što karakteriše minuskulu veze, odnosno snagu koja okreće kuli u poziciju ravnog; gospodin - postavlja se masa kul (atoma) koji se računaju za formule

Frekvencije valentnog prstena određene su masom atoma i energijom (energijom) veze. Chim masa više, tim manje frekvencija, na primjer:
n C-C" 1000 cm-1; n C-H» 3000 cm -1
Chim zv'yazok mítsníshiy, tim vshe učestalost colivana, na primjer:
Moguća je pojava prizvuka - colivan, čija je frekvencija u cijelom broju puta veća, niža u glavnim ( 2n, 3n i sl.). Ozvučite jačinu prizvuka malo manje: za prvi prizvuk postavite ga na 1-10% intenziteta glavnog tona; Treći prizvuk će zvučati bez ulaženja u njega.
Sistem od tri ili više atoma može imati dva tipa valentnog kolivinga - u fazi (u jednoj fazi ili simetrično, n s ) i antifaza (u različitim fazama, ili antisimetrična, as ) (slika Y), iako su termini često stagnirajući u simetričnim molekulima. Učestalost antifazne kolivanije je veća, niža od infazne.
Deformacija kolyvannya pov'yazaní íz zminoy valence kut, zvízki zvíyazki zagalny atom; smradovi su označeni slovom d . Pogledajte neke deformacijske pukotine prikazane na sl., Z. Za oštećenje deformacijskih pukotina potrebno je manje energije, niže za različite valentne pukotine, a kasnije, smrad može imati nižu frekvenciju.
Sa povećanjem broja atoma u molekulu, broj mogućih colivana brzo raste. U pravoj molekuli, atomi su usko povezani jedni s drugima i međusobno djeluju. Spektri molekula su sklopivi skup različitih koliforma, koji se pojavljuju na koži u uskom frekvencijskom intervalu.
Intenzitet gline se određuje, kao i kod UV spektroskopije, molarnim koeficijentom glinovitosti, međutim, u ovom slučaju je tačnost manja. Ozvučite intenzitet smoga jer se ispostavilo da je glina (A) ili prijenos (T) svjetlosnog toka u procentima. Smugi je također ocijenjen po intenzitetu kao jak ( With.), srednji ( pošto.) i slab ( sl.).
Otrimanja ÍCh spektri
Osnova odabira ÍH spektra je ležanje direktno na glinenim vibracijama za sat vremena prolaska kroz klupko govora. Iz velikog raspona ÍH vikaričnosti, zvuči vikoristički srednji region (400-4000 cm -1). U području bliskog IC (4000÷14300 cm -1) važniji su tonovi, da se izvrši drugačija analiza. Na daljinu, IF-regija (100÷400 cm -1) će vjerovatnije ispljunuti zvukove metala uglja.
Šema IF spektrometra je slična šemi UV spektrometra, ali je sistem dodatne opreme više sklopiv. ÍCh viprominyuvannya ê termalna; upotrijebite keramičku frizuru da posluži kao džerel, koji se pali da prođe električnim mlazom. Uz pomoć sistema ogledala, svetlosni tok se deli na dve identične izmene, od kojih se jedna propušta kroz kivetu sa govorom, a druga - kroz kivetu vode. Prošao je kroz kivete vibracije da bi ušao u monohromator, koji se sastoji od prizmi, ogledala i proreza, koji se obavijaju, što vam omogućava da vidite vibraciju sa strogo zadatom frekvencijom i glatko menjate frekvenciju. Vrakhovuchi, da u regiji ÍCh ima više neprozirnih govora, prizme se prave od monokristala soli. Priključci visoke klase treba da imaju tri prizme: LiF(2000÷3800 cm -1), NaCl(700÷2000 cm -1) to KVR(400÷700 cm -1). Koža iz prizme u drugom intervalu xvili brojeva daje znatno manju dozu. U brojnim uređajima disperzija vibracije je razvijena uz pomoć difrakcionih filtera. Intenzitet dvaju svjetlosnih tokova (glavni je isti) koji su prošli kroz monohromator, jedan od njih se automatski prikazuje. Električni signal, koji se uspostavlja kada rezultujući svjetlosni tok udari u detektor tipa termoelementa, pojačava se i bilježi samopisnim potenciometrom. Snimanje ê ÍČ spektra u smislu zaleđenosti gline ili transmisije (u %) u frekvenciji (cm -1) ili trajanju habanja (µm). Tipičan prikaz spektra je prikazan na sl.

IF spektri se najčešće mjere ovim redoslijedom:
1. Razchini govori najkorisniji za odabir spektra, jer u ovom slučaju dolazi do međumolekularnih interakcija. S tim u vezi, da je u ÍH regionu glina kao govor, kao rozčinnici vikorista najjednostavnije strukture, spektra neke od najjednostavnijih vrsta (minimalna količina samozadovoljstva), a najčešće - čotiriklonog uglja, koji je više od 1300 cm -1.takođe sirkovoolets, praktično bistar i niži od 1300 cm -1. Slijedom toga, nakon ponovnog pisanja govora u tom drugom trgovcu, počinjemo zapisivati cijeli infracrveni spektar.
Za rozchinív zastosovuyt cilindrične kivete debljine 0,1 ÷ 1,0 mm od vena iz slanih ploča. Za punjenje kivete potreban volumen je 0,1 - 1,0 ml pri koncentraciji od 0,05 - 10%.
2. Tanki kupaći kostim (<0,01 мм) жидкого вещества, помещенные между солевыми пластинами, удерживаемыми капиллярными силами.
3. Graze, koji se pripremaju za praćku tvrdog kamena vazelinskim uljem i stavljaju blizu tanke kuglice između ploča soli. Samo vazelinsko ulje, koje je sažeto u ugljikohidratima, intenzivno tamni u području od 2900 cm -1 i 1400 cm -1. Heksahlorobutadien se ponekad koristi za pripremu vikor paste, otvor je veći od 1600 cm -1 i područje je 1250 ÷ 1500 cm -1, dakle u tihim intervalima frekvencije, u kojima se gline vazelinsko ulje.
4. Čvrsti govori izgledaju kao fini prah(0,5÷1,0 mg), temeljno pomešan sa prahom kalijum bromida (~100 mg), a zatim pritiskom na poseban nastavak ispod škripca do "4,5 × 10 8 Pa tanka ploča.
5. Metoda oštećena ukupna unutrašnja fermentacija(NVO):

Količina govora, koja je neophodna za ÍK spektar, bez obzira na način pripreme uzorka, iznosi 0,5÷2 mg.
Krhotine materijala za kivetu i slane ploče, oko nije krivo za osvetu. Metoda ÍCh-spektroskopije jedna je od najdostupnijih u laboratorijskoj praksi. Samo ga stavite u upotrebu, za odabir spektra vam je potrebna papalina pahuljica.
Druga vrsta spektra koji nose informacije o koagulaciji u ovom opsegu, ê spektri kombinatornog rozsíyuvannya (KR).

Njihova glavna karakteristika je fiksacija dožina hvila, što je važnije u vidljivom opsegu. Umovoy ih otrimannya je visokointenzivni džerel visokomonohromatičeskog vpromínyuvannya, često laser, i nekoliko linija atomskog spektra luminiscentne živine lampe niskog pritiska.
Spektar se smiruje zbog ne-proljetnih interakcija fotona svjetlosnog snopa s govornim molekulima. Foton, držeći se elektrona molekula, može prenijeti još veći nivo molekularne energije, trošeći dio svoje energije. Linije koje se pojavljuju Stokes's . Moćan zamah, ako se foton zalijepi za elektron, koji je na visokom molekularnom energetskom nivou, i prenese jogu na nižu orbitalu, skupljajući dio energije. Postoje linije koje su simetrične sa Stokesom i glavnom linijom (foton koji pada) i rangira se anti-Stokes . Stoksivske linije, tobto. manje energije, intenzivno, jer proces prijenosa energije fotona na elektron. Međutim, sve linije Ramanovog spektra su niskog intenziteta u homogenoj svjetlosti (skoro 10 -7 u ukupnom intenzitetu svjetla ruže). Stoga su Ramanovi spektri fiksirani okomito na pravu liniju budnog snopa. Registracija spektra se vrši kao i obično. S kim je bila glavna budna linija n 0 uspostavlja se niz uskih linija, koje n i . Prema vremenu n 0 і n i vrijednosti Dn .
Pogled na spektar je sličan onom na slici u ÍČ spektroskopiji. U modernim uređajima, buđenje ružičaste svjetlosti vibrira se monokromatskom laserskom promjenom, što omogućava da se 1 ÷ 10 mg govora izdaje u ograničenom rasponu. Uzorak se može davati kao čisti izvor ili kao prašak, kao iu čvrstom prahu.
Za pomoć naboja okrivljuje se elektromagnetna kolivanija. Vidpovidno, í̈hnê poglanannya pov'yazane zí zmíschennyam zarídíví. Očigledno je šta je ispravno glina u ÍČ regiji treba da bude ispunjena dovoljnim intenzitetom, kao polarni jezik. U Ramanovim spektrima, intenzivan smog daje simetričnu koliaciju nepolarnih veza, oskílki razí važan dipolni moment, scho u procesu colivannya. Otzhe, na najjednostavniji način koliacija se pojavljuje u IF spektrima, neaktivna u Ramanovim spektrima, i, naizgled, ali. Za simetrične molekule u IF spektrima postoji aktivna antifazna koliacija, dok su u Ramanovim spektrima u fazi. U svijetu je smanjena simetrija molekula bogato koncentrisana i intenzivno se manifestuje u tom drugom spektru. Takođe, IF i CR spektri se međusobno dopunjuju, a kombinovanom upotrebom ovih metoda može se oduzeti maksimalna informacija o učestalosti kolivinga analiziranog govora.
Smugi u kolyalnyh rasponima podijeljeni su u dvije vrste. Karakteristično(važno valentinskog) smoga, prisustvo takvog u spektru dovodi do prisutnosti preostalog govora pjevajućih strukturnih elemenata.
Karakteristika ê tí colivannya, yakí želite b za jedan parametar (gospodin ili F ) istotno v_dryznyayutsya u glavnom colivingu S-S (razdvajanje svjetlosnih atoma: S-N, O-N, N-N broj više veza).
Za colivaniju je karakteristično ležanje uz zvuk pjevanja ja, otzhe, može postići konstantnu frekvenciju u različitim govorima, jer se mijenja manje od troha za rahunok interakcije s otopinom molekula.
Nekarakteristično smugi, koji zauzimaju površinu od 400÷1000 cm -1, pokazuju numeričke valentne pukotine, koje se ne javljaju C-C, C-N, N-O ta deformacija colivanya. Ovo područje je kolivan karbonskog skeleta molekule, jer oštro reagira na najmanje promjene u strukturi molekula. Nekarakteristične kolivanije koje čine glavni dio spektra i kožni govor čine svoj vlastiti, neponovljivi skup smoga. Ne postoje dva uzastopna enantiomera (optički antipodi), iako postoji nekoliko identičnih infracrvenih spektra (IR spektra). Tsim često kora za uspostavljanje istovetnosti govora, krhotina sbíg ÍH spektri ê usaglašavanje dokazom identiteta preostalih uzoraka.
Vrahovyuchi, da se u spektru jednog govora uvek može naći smuga, kao dan u spektru drugog, Mogućnost slične analize suma, kao i spektra komponenti u kući.
U isto vrijeme, može doći do pobjedničke analize puta vimiruvanja intenziteta močvara. Ako je već ugrađen budovski govor, u nekarakterističnom području spektra vide se đakoni smugi uz pjesme koliva.
Međutim, pred posljednjim danom, stanite pred sljedeći zadatak - stavite kuću iza spektra. U kom smislu mogućnost ÍH spektroskopije ne treba ponovo procenjivati, sljedeći pobjednik je manje od apsolutno vrhunskih kriterija.
Socrema, podaci, preuzeti sa gledišta površine niže od 1500 cm -1, ne mogu se smatrati dokazom, već samo dokazom ozbiljnosti prisustva drugog konstruktivnog elementa. Prije pomilovanja brkova, možete iznijeti varijaciju strukturnih promjena (zokrema, odabrana konformacija i najbliže izoštravanje) malih promjena u vrijednosti karakteristične frekvencije.
Drugim riječima, Iz kolivalnih spektra nema ni traga uzetim informacijama, čija je pouzdanost sumnjiva.
Za opisivanje kolivatnih spektra najčešće se koriste sljedeće informacije:
Kolivannya zv'yazku S-N. Valentno pucanje C-H na velikom atomu ugljika pojavljuje se u području od 2800-3000 cm -1. Za acikličke i ne-zatezne cikličke strukture, n CH može imati uvredljive vrijednosti (cm -1):
| CH 3 | 2962 cm -1 | 2972 cm -1 |
| CH 2 | 2853 cm -1 | 2926 cm -1 |
| CH | 2890 cm -1 |
Smugi je karakterističan, ali ne baš informativan, jer se u govoru bojite različitih zvukova S-N , yakí, osim toga, mogu vzaêmodíyati među sobom. Zadimljene pahuljice su naslagane jedna na jednu, zadovoljavajući u području od 2800÷3000 cm -1 smugu, koji može imati slabo izražene maksimume. Za potrebe strukture govora smuga, oni mogu samo u tom slučaju biti crveni, jer u vodi ima malo atoma, na primjer, u polihaloalkanima. Prisustvo smoga u ovom galusu je pomirenje dokaza prisustva atoma u govoru u vodi sa najviše atoma ugljika.
Deformacija colivannya dCH , širi se u području od 1350÷1470 cm -1 , niske karakteristike, ali se može prikazati u spektru:
| CH 3 | 1375 cm -1 | 1450 cm -1 |
| CH 2 | 1475 cm -1 |
Karakteristično je dodavanje dvije metil grupe na jedan atom ugljika (geminalna supstitucija), čime se stvaraju dva bliska maksimuma (dubleta) približno jednakog intenziteta u području od 1370÷1385 cm -1.
Informativni sadržaj spektra može se povećati, prekomjerne razlike u frekvencijama cijepanja zvukova, kako bi se osvetile različite izotopske modifikacije atoma. Zocrema, često zamjenska deuterirana polovina, obogaćena deuterijumom umjesto protijumom.
U analizi spoluka, označenog deuterijumom, još karakterističnija smuga n CD 2100 ÷ 2160 cm -1 je zasađeno u regiji, praktično u ostalim danima smuge.
Colivannya zv'yazku C=C. U z'ednannyah íz ízolovanim podvíynym zv'yazyk v c = c koji se nalazi na 1600-1680 cm -1.
U cikličkim sistemima, posebno naponima, vrijednosti frekvencije su tri puta niže. Učestalost colivan-a subvíyny zv'yazku postupno raste sa sve većim koracima njene zamjene, na primjer:

U IF spektrima, simetrične supstitucije alkena (nepolarna supstitucijska veza) n S=S manifestuje se u roju oskudno niskog intenziteta, kao, na primer, u spektrima semestra (I) i (III); za asimetrično zamijenjenu viseću kariku (na primjer, z'ednannya II), intenzivno je završiti samozadovoljstvo. Ramanski spektri imaju colivanya C=C u vremenima aktivniji, niži u ÍH spektru, i bez obzira da li ligacija podžicom daje napregnutu (zvuk najintenzivniji u spektru) liniju ili ne. Smuha (smuha) može biti karakteristična za prisustvo govora podzemne željeznice. n=CH , mljevena u području od 3000-3100 cm -1 .
Deformacija colivannya d=CH može se prilagoditi za označavanje konfiguracije posrednika u slučaju viseće veze: za cis-izomere, smrad se širi u području od 650÷750 cm -1 , a za trans-izomere - u području od 960÷970 cm -1 .
Na ovaj način, na osnovu ovih kolyvalnyh spektra (posebno CR spektra), može se otkriti prisustvo izolovanog subfolding ligamenta u govoru i postoji prekinuto pevanje vysnovke o prirodi zamene.
Smuha n = C D još je karakterističniji (2200÷2300 cm -1) i omogućava ubrizgavanje atoma deuterija, koji se nalazi sa karikom lanca, kao D atom sa velikim atomom ugljika.
Colivannya pov'yazanih díênovih sistema.
Dobio novi sistem u području od 1500 ÷ 1650 cm -1, postoje dva smuga, koji pokazuju dva tipa valentnog kolivinga - infazni i antifazni, na primjer: 
U cijeloj grupi smugova, cijepanje dina sistema u IF i Ramanovom spektru je značajno intenzivno u odnosu na izolaciju podpreklopnih veza, kao rezultat toga, sistem dina može imati transpozicionu konfiguraciju. U IC spektru je aktivnija kolikacija, kao iu Raman spektru. U infracrvenom spektru simetričnih podjela (na primjer, butadien), intenzitet smoga može biti značajno nizak. Uvođenjem alkil supstituta u dienski sistem, vrijednosti frekvencija se i prirodno kreću. Kolivania n=CH u dienima se pojavljuju u istom području kao i u alkenima (3000÷3100 div -1).
Na ovaj način, prisustvo govora u dijagnostičkom sistemu može se lako pripisati nazivima kollyalnyh spektra. Sa dodatkom podvarijantne veze sa aromatičnim jezgrom, frekvencija zvonjenja se pomera u niskofrekventno područje (za 30 cm -1), s kojim se povećava intenzitet omotača. Sa povećanjem broja koplja, pojava (u spektrima poliena) povećava količinu smoga n S=S , štaviše, frekvencije njihovih zvukova se mijenjaju, a intenzitet se značajno povećava.
Kolivania aromatični sistemi. Valentno pucanje C-Z zvijezda benzenskog prstena daje intenzitet zadimljenosti na 1585-1600 cm -1 i 1400-1500 cm -1, tako da nisu zgodne za identifikaciju, jer je područje blizu colivana n C =C. Broj n CH arena se nalazi u području od 3020-3100 cm -1; Smradovi se manifestuju u grupi smoga srednjeg intenziteta, ponekad i više, niže u glinonosnim u istom regionu n = CH alkenivi.
U spektrima aromatičnih ploča, postoji intenzivan smog neiskvarljivih deformacionih pukotina S-N u području od 650÷900 cm -1. Ovaj region daje mogućnost određivanja količine i skladištenja supstituta u aromatičnom jezgru, kao i međusobnog slaganja benzenskih prstenova u polinuklearnim aromatičnim puževima. Po pravilu, prisustvo jakog smoga u području od 650-900 cm -1 ukazuje na prisustvo aromatičnog jezgra u govoru. Osim toga, u ovom galusu se manifestiraju coli-coal-halogen zvukovi, štoviše, smugi može zvučati visokog intenziteta: C-Cl (550÷850 cm -1), C-Br (515÷690 cm -1), C-I (500÷600 cm -1). Pozivanje zvuka C-F pojavljuju se u području skeletnih ligamenata S-S preteško ih je pratiti. Vykoristovuvat kolivanie zv'yazkív ugljen-halogen u svrhu halogena u skladištenju govora nije razumno (ê bezlične metode u najboljim i najtačnijim), već za zaštitu industrijskih proizvoda i međuzavisnost nastalih mehanizama reakcija, može se dati izgled smoga.
Da bi se utvrdio položaj intercesora u aromatičnoj jezgri, površina od 1650 ÷ 2000 cm -1 odstupila od vikorističkog područja od 1650 ÷ 2000 cm -1 je isključivo slabih prizvuka i nijansi više preklapanja. Smugi u ovom galuzi je ugar zbog prirode zamjene, ima drugačiji obris. Površnost znakova je mala, a osim toga, ovo područje se preklapa zbog prisustva govora karbonilne grupe.
Spektri kolizije najvažnijih heterocikličkih sistema mogu biti bogato složeni sa spektrima sličnim benzenu: na primjer, za furan, tiofen, pirol i piridin n CH 3010÷3080 cm -1 ta n C-C (kíltse) 1300÷1600 cm -1, štaviše, položaj smuge v C-C moguće je deponovati prema tipu heterocikla i prirodi supstitucije. Imati tsíy galuzí možete winknut víd dvoh to chotirioh swag. Sniziti glavne frekvencije u spektrima najvažnijih heterocikla (cm -1)
Kolivannya zv'yazku SºS. Prisustvo veze zvuči roj valentnih colivana 2100 ÷ 2250 cm -1, jer imaju tsíy galuzí ínshí smogi su praktično svakodnevno. Smog srednjeg intenziteta, sa simetričnom supstitucijom u ÍCh spektru, može postati praktički neupadljiv, u Ramanovom spektru, smuga je aktivna i ima veći intenzitet od manje simetričnog alkina.
Kolivania zv'yazku O-N. U visoko oplemenjenim sortama, koje obezbeđuju prisustvo intermolekularnih interakcija, hidroksilne grupe se manifestuju visokointenzivnom maglom valentnih kolivana 3200-3600 cm-1. Ako hidrokso grupa učestvuje u vodenoj vezi, tada formiranje tog karaktera linije počinje da se snažno taloži u stepenu zračenja, jer. počinje da menja nasilni stalni poziv. Kao međumolekularna veza, čini se da je široka nestrukturirana smuga koja prelazi cijeli raspon od 3200÷3600 cm -1. U pravilu se uočavaju intramolekularne veze vode, što ukazuje na intenzivan smog od blizu 3500 cm -1, pomjeren u niskofrekventno područje, jednak velikim grupama. Zbog jedinstvenosti mogućnosti uspostavljanja intermolekularnih veza, sljedeći vikoristi bi trebali biti malopolarni trgovci (u ugljikohidratima, CCl 4) i koncentracija je manja od 5 × 10 -3 mol/l. Podli fenol hidroksid ispoljava ženka valentne coli 3600÷3615 cm -1 visokog intenziteta.
Deformacija cijepanja hidroksogrupa truljenja u području od 1330-1420 cm -1 i malo za identifikaciju. Dimeri karboksilnih kiselina pojavljuju se u širokom intenzivnom smogu u području od 1200÷1400 cm -1.
Kolivania zv'yazku S-O. Zvezda se manifestuje u eterima i alkoholima u intenzivnoj izmaglici oblasti 1000÷1275 cm -1. Sklopivi eteri u spektrima zamjenjuju dva smuga za C-O-C grupu: simetrični coli 1020÷1075 (slabiji u IF spektru) i antisimetričan na 1200÷1275 cm -1 (slabi u Raman spektru). U ovom rasponu ispoljavaju se smogovi različitih grupa, a smogovi su nekarakteristični, a najčešće je sam smrad najintenzivniji.
Colivannya zv'yazku Z = O. Valentno cijepanje karbonilne grupe prisutno je u spektrima različitih vrsta: samo aldehidi, ketoni, karboksilne kiseline i anhidridi. Ovo je visoko aktivan vrh u području od 1650÷1680 cm -1 , inače je praktično svakodnevno. Ovo je jedan od najkarakterističnijih smogova, njeno prisustvo ili prisustvo se može pomiriti dokazom prisustva ili prisustva karbonilnih grupa. Specifičan raspon manifestacije smoga leži u susidníh grupama i grupama, karbonil je uključen u jaka, indukcijski učinak (-I) mijenja dugovječnost C \u003d O i stoga se povećava snaga konstantne frekvencije . Za aldehide i ketone smuga oni su blizu 1710÷1750, za karboksilne kiseline - 1650÷1695,18 - 1865÷1875, bezvodne kiseline - 1740÷1790 i 1800÷1850 cm -. Efekat dobijanja p-elektrona smanjuje učestalost koagulacije: u sistemima C=C-C=O i C 6 H 5 -C=Pro, smuga se meša na oko 1665÷1685 cm -1.
Na taj način spektri ugljičnih polja nam omogućavaju da uzmemo veliki dio nedvosmislenih informacija, posebno kada se pogledaju drugi smugovi: za savijanje etera i anhidrida - smuga C-O , amidiv - smuga N-H , spektri aldehida često imaju smuga grupu DREAM zatvori 2695÷2830 cm -1 . Za bogate aldehide, ovaj spektar ketona je zbir glavnih i enolnih oblika.
Veze spektralnih manifestacija različitih grupa u ÍH i Ramanovom spektru prikazane su u tabelama br. 2, u svrhu pojašnjenja posebnih tabela, koje omogućavaju veći skup frekvencija i omogućavaju dodavanje praktičnih skupova smogova u različitim oblastima.
Tabela br. 2 Glavne frekvencije colivana u ÍCh-spektroskopiji
| Frekvencija cm -1 | Intenzitet | priroda kolivani | Vrsta narudžbe | |
| 3620- 3600 | s., povn. | n VIN (besplatno) | Razvio asortiman alkohola | |
| 3600- 3500 | s., povn. | n VIN (glas) | Intramolekularne vodene veze u alkoholima | |
| s., povn. | (Viln.) | Istraživanje porijekla prvih amida | ||
| 3400- 3350 | pošto. | n NH (besplatno) | Sekundarni amini, N-supstituirani amidi | |
| 3550- 3520 | s., povn. | n OH (besplatno) | Razblaženja kiselina | |
| 3500- 3400 | s., povn. | n NH2 (besplatno) | Primarni amen, amidi | |
| With. | (Viln.) | Razrijeđeni amidi | ||
| 3330- 3260 | pošto. | n ºCH | Jednozamjenski alkin | Alkani |
| 1370- 1390 | s., povn. | Nitrospoluky | ||
| 1280- 1200 | With. | n SOS | Sklopivi vazduh | |
| 1250- 1180 | pošto. | n C-N | Tercijarni amini (ArNR 2 , (RCH 2) 3 N) | |
| 1220- 1125 | With. | n C-O | Sekundarni, tercijarni alkoholi | |
| 1200- 1160, 1145- 1105 | s., povn. | n C-O | Ketali, acetali | |
| 1150- 1050 | With. | Efiri | ||
| 1085- 1050 | s., povn. | n C-O | alkohol | |
| 970- 950 | pošto. | dCH | Trans-alkeny | |
| 900-650 | With. | dCH | Areni | |
| 750- 650 | pošto. | d=CH | Cisdieni |
| Otkucajte zv'yazku ta z'ednan | Frekvencija cm -1 | ||
| -C=C- | |||
| alkenije | 1680- 1620 | ||
| cis-pokhídní | 1665- 1635 | ||
| trans-friendly | 1675- 1660 | ||
| ciklično | 1650- 1550 | ||
| po'yazaní | 1660- 1580 | ||
| -C=C=C- | |||
| aleni | 1970-1940 (kao) | ||
| 1070-1060 (ns) | |||
| -CºC- | |||
| Alkini | 2270- 2190 | ||
| -CºC-H | 2140- 2100 | ||
| ss=pro | |||
| Ketoni | alifatski | 1725- 1700 | |
| nepostojeće | 1690- 1660 | ||
| aril keton | 170- 1680 | ||
| diarilketoni | 1670- 1660 | ||
| ciklično | 1780- 1700 | ||
| diketoni | a | 1730- 1710 | |
| b | 1640- 1635 | ||
| Aldehid | alifatski | 1740- 1720 | |
| nepostojeće | 1705- 1650 | ||
| aromatično | 1715- 1685 | ||
| karboksilne kiseline | monomer | ||
| dimer | 1725- 1700 | ||
| nepostojeće | 1715- 1680 | ||
| aromatično | 1700- 1680 | ||
| lactoni | 1850- 1720 | ||
| anhidridi | |||
U isto vrijeme, u svjetlu promjene kolivalnog kampa molekula, mijenja se i taj kamp za zamatanje joge. Promjena kolyvalnyh i obertalnyh stanív za proizvodnju viniknennya obertalno-kolyvalnyh spektra. Kolivalna energija molekula je oko sto puta veća od njene energije omotača, što ne oštećuje kolivalnu strukturu molekularnih spektra. Superpozicija malih u smislu energije ukupnih kvanta na jednako velike u smislu energije kolivalne kvante, pomičući linije kolivalnog spektra u blisko infracrveno područje elektromagnetnog spektra i pretvarajući ih u samozadovoljne. Z tsíêí̈ uzrokuje obertal-colival spektar, koji poserígaêtsya u bliskoj infrachervoníy dilyantsí, može biti linearno glatka struktura.
Smuga kože takvog spektra ima središnju liniju (isprekidanu liniju), čija je frekvencija određena razlikom u terminima molekula. Kontinuum takvih frekvencija je čisti spektar cijepanja molekula. Kvantno-mehaničke ekspanzije, povezane sa odlukama Schrödingerovog poravnanja linije kose sa prilagodbama međusobnog ubrizgavanja stanica za umotavanje i udaranje molekula, dovedene su u zaokret:
de í ê postíynimi vsím energíchnyh rivnív i depozit víd kolivalny kvantni broj.
de - postíyní, manje veličine, niže i. Zbog nedostatka parametara í, u jednakim količinama í, sa najmanjim skladištima u ovim spívvídnenjah može znekhtuvat i jasno vidjeti okluzalno-kolivalnu energiju molekula, kao i zbir colivalne i obertalne energije zhorstkoy molekula, takođe na drugačiji način:
Cey viraz ljubazno prenosi strukturu spektra i čini manju vjerovatnoću da će se dogoditi pri velikim vrijednostima kvantnih brojeva ta. Pogledajmo obertalnu strukturu obertal-kolivalnog spektra. Dakle, kada viprominuvani molekuli prelaze sa viših energetskih nivoa na niže, au spektru su linije sa frekvencijama:
tobto. za linijsku frekvenciju otvorenog kolivalovog spektra može se napisati na sljedeći način:
Kombinacija frekvencija daje spektar otvorenog sudara. Prvi član u ovom slučaju jednak je spektralnoj frekvenciji, što je posljedica promjene samo kolivalne energije. Pogledali smo linije omotača smugova spektra. Na granicama jedne smuge njenoj tankoj otvorenoj strukturi pripisuje se više od vrijednosti otvorenog kvantnog broja. Za takav samozadovoljstvo možete zapisati na licu mjesta:
Vídpovídno na vladavinu vidbora Paulí:
cijela smuga je podijeljena u dvije grupe spektralnih serija, kao da se roztashovuyutsya duž obje strane. Tako je, tako je:
tobto. ako:
onda uzimamo grupu linija:
tobto. ako:
onda uzimamo grupu linija:
U trenucima tranzicije, ako molekul pređe sa 3. otvorene linije na otvoreni energetski nivo, grupa spektralnih linija je određena frekvencijama. Tsya grupa linija naziva se pozitivnim ili mekim smogom spektra, koji se zasniva na z. Tokom prijelaza, ako se molekul pomakne sa th na energetski nivo, otkriva se grupa spektralnih linija sa frekvencijama. Tsya grupa linija naziva se negativnim ili - mekim smogom spektra, koji se zasniva na z. Tse tim, scho značenje, scho vídpovidaê nema fizički osjećaj. - i - gílki smuga, gleda van pogleda:
sastavljene su od redova:
Ovim redom, dermalna smuga obertal-colival spektra se sastoji od dvije grupe jednako udaljenih linija i između suicidalnih linija:
za pravi netvrdi molekul, koji je jednak:
za frekvenciju linija - ta - g_lok smuga, otrimuemo:
U tragu ove linije - i - orlovi se uvijaju i čuvaju ne jednakim udaljenim linijama, već - strehama, koji se razilaze i - orlovima, koji se približavaju odlukama kanta smuge. Na taj način se kvantna teorija molekularnih spektra pokazala korisnom pri dešifriranju spektralnog smoga u bliskom infracrvenom području, tumačeći ih kao rezultat jednosatne promjene ukupne i kolivalne energije. Značajno je da su molekularni spektri vrijedan izvor informacija o budućnosti molekula. Vivčajući molekularne spektre podataka, moguće je pronaći različite diskretne energetske molekule i na bazi dobivenih podataka za postizanje pouzdanih i točnih zaključaka u vezi s kretanjem elektrona i okretanja u molekulima, a također se dobijaju točne informacije o silama između atoma u molekulama, međuodnosa i geometrije disocijacija jezgara u molekulima, energija disocijacije samog molekula i u.
Molekularni spektri- spektri gline, viprominyuvannya ili rozsiyuvannya, za koje se okrivljuje kvantne tranzicije molekula iz jedne energije. Ja ću biti do sljedećeg. Gospođa. određuju skladište molekula, njena struktura, karakter hem. zv'yazku da vzaêmodíêyu s vanjskim. polja (i, kasnije, sa izolovanim atomima i molekulima). max. karakteristično za pojavljivanje M. sa. rijetki molekularni plinovi, ako svaki dan proširenje spektralnih linija nepropusnost: takav spektar se sastoji od uskih linija sa Doplerovom širinom.
Rice. 1. Šema jednake energije dvoatomske molekule: aі b-elektronski jednaki; u" і u"" - kolivatní kvantni brojevi; J"і J"" - otvoreni kvantni brojevi.

U molekulu postoje do tri sistema jednake energije - elektronski, kolivalni i otvoreni (slika 1), M. s. sastoje se od ukupnosti elektronskih, colivan. vrtim se. spektri i leže u širokom rasponu el-magn. hvil - vrsta radio frekvencija do X-zraka. sferni spektar. Učestalosti prijelaza između omotača. sa jednakim energetskim nivoima, zvuk se troši u mikrotalasnoj oblasti (na skali mikrotalasnih brojeva 0,03-30 cm-1), frekvenciji prelaza između kolibata. linije - u ÍCh-regiji (400-10 000 cm -1), a frekvencije prelaza između elektronskih linija - u vidljivom i UV području spektra. Tsei podíl umovny, da se često uvijati. krenuti dalje iu ÍCh-regiju, colivania. tranzicija - u vidljivom području, a elektronski prelazi - u ÍČ-regiji. Zvuk elektronskim prijelazima praćen promjenom zvuka. energije molekula, i kada živi. prelazi se mijenjaju i prelamaju. energije. Za to je elektronski spektar najčešće predstavljen sistemom elektronskih oscilacija. samozadovoljno, štaviše, sa velikom raznolikošću zgrada, spektralna oprema izgleda da ih obavija. strukture. Intenzitet linija i samozadovoljstva u M. s. označava imovirnistyu sličnog kvantnog prijelaza. max. intenzivne linije potvrđuju prelaz dozvoljen prema pravilima. Do M. s. vidi također Auger spektre i X-zrake. spektri molekula(Članci se ne vide; div. Auger efekat, Auger spektroskopija, rendgenski spektri, rendgenska spektroskopija).
Elektronski spektri. Čisto elektronski M. s. vinikayutsya kada se mijenja elektronska energija molekula, tako da kada tsmu ne mijenjaju colivan. vrtim se. energije. Electronic M. s. posterígayutsya kao u glini (spektri gline), tako i u vipprom_nyuvanni (spektri). Kod elektronskih prijelaza ozvučite električnu promjenu. . Teško. dipolni prelaz između elektronskih stanja molekula tipa G "
ta G ""
(Div. Simetrija molekula) je dozvoljeno, kao direktni tvir G "
G ""
zamijeniti tip simetrije uzimanjem jedne od komponenti vektora dipolnog momenta d
. U spektrima glinovanja postoje znaci prelaza od glavnog (ukupno simetričnog) elektronskog mlina ka buđenju elektronskog mlina. Očigledno je da za stvaranje takvog prijelaza tipa simetrije pobuđenog može doći do pada dipolnog momenta. T. to. Ako dipolni moment ne leži u spinu, tada se u toku elektronskog prelaza spin treba sačuvati, tako da je moguće proći između mlinova samo sa istom mnogostrukošću (interkombinacija ograde). Ovo pravilo je, međutim, prekršeno
za molekule sa jakom spin-orbitalnom interakcijom, što može dovesti do interkombinacijski kvantni prijelazi. Kao rezultat takvih prijelaza, na primjer, okrivljuju se spektri fosforescencije, koji kao da ukazuju na prijelaze iz pobuđenog tripletnog mlina u glavni. jednogodišnji mlin.
Molekuli različiti Elektronski često postaju drugačiji geom. simetrija. U takvim vipadkama uma G "
G ""
G d može se koristiti za grupu tačaka konfiguracije niske simetrije. Međutim, sa različitom permutaciono-inverzionom (PI) grupom, ovaj problem se ne može kriviti, jer se PI grupa za sva stanja može uzeti isto.
Za linearne molekule simetrije Z hu tip simetrije dipolnog momenta G d=S + (dz)-P( d x , d y), tada vam je dozvoljeno prijeći preko S + - S + , S - - S - , P - P tada. bud. sa dipolnim momentom prijelaza, uspravljajući se duž ose molekula, i prelazi S + - P, P - D tada. e. sa momentom prijelaza, uspravljajući se okomito na osu molekula (značaj položaja razd. u st. Molekula).
Ymovirnist AT električni dipolni prelaz sa elektronskog nivoa t na elektronsku valutu P, pídsumovana na svim kolivalno-overt. jednako elektronskim jednakima t, označava f-loy:
matrični element dipolnog momenta za prijelaz n-m,y en i y em- hvilyoví f-tsíí̈ elektronív. Integralni koeficijent. poglinannya, koja se može eksperimentalno testirati, prepoznaje viraz
de Nm- Broj molekula po pm. postati m, v nm- Prijelazna frekvencija tP. Često se karakterišu elektronski prelazi
Autor Hemijska enciklopedija r.n. I.L.KnunyantsKOLIVANI SPECTRIES, movlyav. spektri uvećani kvantnim prijelazima između nivoa molekularne energije. Eksperimentalno poserígayutsya kao ÍČ spektri poglanannya i kombinacije spektra. rozsiyuvannya (KR); opseg brojeva fluktuacije ~10-4000 cm -1 (frekvencije prelaza pulsiranja 3 . 10 11 -10 14 Hz). Swing. jednake energije se pripisuju kvantizaciji kolateralnog kretanja atomskih jezgara. Dvovolumenski molekuli. Na najjednostavniji način, dvoatomska molekula je predstavljena modelom dviju masa tačaka m 1 i m 2 u međusobnoj interakciji sa jednako važnom razlikom r e između njih (dvostruka veza), a pulsiranje jezgara se smatra harmoničnom i opisuje se kao jedinica, koordinata q = rrr e, de internuklearni stalak. Taloženje potencijalne energije kolyvalny ruh V víd q određeno je obližnjim harmonijama. oscilator [materijalna tačka stupca sa indukovanom masom m = m 1 m 2 / (m 1 + m 2)] kao funkcija V = l / 2 (K eq 2), de K e = (d 2 V / dq 2) q \u003d 0 - harmonije. snaga je jaka 
Rice. 1. Taloženje potencijalne energije V harmonija. oscilator (isprekidana kriva) i realna dvoatomska molekula (sucilarna kriva) u internuklearnoj liniji r (r sa jednako važnim vrijednostima r); horizontalne ravne linije označavaju kolivalní rivní (0, 1, 2, ... vrijednost kolivalnog kvantnog broja), vertikalne strelice - deakí kolívalní prijelazi; D 0 je energija disocijacije molekula; zasjenjeno područje odgovara sucilijanskom spektru. molekula (isprekidana kriva na slici 1).
Vidpovidno do klasika. mehanika, harmonijska frekvencija. vagon ![]() Kvantno-mehanički pregled takvog sistema daje diskretni niz čak i udaljenih energetskih jednakosti E(v)=hve (v+ 1/2), de v = 0, 1, 2, 3, ... - kvantni broj, v e - harmonije. kolivalna je postala molekul (h - postao Planck). Prilikom prolaska između bočnih linija, prema pravilu selekcije D v=1, foton sa energijom hv= DE=E(v+1)-E(v)=hv e (v+1+ 1/2)-hv e ( v + 1 / 2) = hv e, pa je frekvencija prijelaza između to dvoje ista, a ista je, štaviše, učestalost prijelaza između to dvoje je ista, a klasična frekvencija harmonija. kolivan. To v e se također naziva harmoničnim. frekvencija. Za stvarne molekule, krivulji potencijalne energije nije dodijeljena kvadratna funkcija q, odnosno parabola. Swing. jednaki daedali su bliže blizini intermolekularne disocijacije molekula u anharmoničnom modelu. Oscilator je opisan jednak: E(v)=, de X 1 - prvi je postao anharmoničan. Učestalost prijelaza između supstantivnih jednakih se ne prekoračuje, a, štoviše, moguće je ukrštanje, što je u skladu sa selekcijskim pravilima D v = 2, 3, .... Učestalost prijelaza iz jednakog v = 0 do jednakog v = 1 naziva se glavna ili osnovna frekvencija. Prelazak od jednakog v = 0 do jednakog v> 1 daje frekvencije prizvuka, a odlazak od jednakog v> 0 daje takozvane vruće frekvencije. U IF spektru glinenih dvoatomnih molekula, kolivalne frekvencije su uočene samo u heteronuklearnim molekulima (samo HCl, NO, CO), štoviše, pravila odabira se mijenjaju promjenom njihovih električnih. dipolni moment pri kolivacijama U Ramanovim spektrima, frekvencije kolivacije se opažaju za bilo koje dvoatomske molekule, i homonuklearne i heteronuklearne (N 2 , O 2 , CN í itd.), budući da su za takve spektre pravila selekcije određena promjenom polarizabilnosti molekula kod colivinga. Vychayutsya s KOLIVANI SPECTRUM str. harmonije. Konstantne K e i v e, konstantni anharmoničnost, kao i energija disocijacije D 0 važne su karakteristike molekula koje su neophodne za zokremu, za termohemijske ruže. Proučavanje colival-overtalnih spektra gasova i para omogućava određivanje obertalnog post-V (div. obertal spektra), momenata inercije i internuklearnih stanja dvoatomskih molekula. Bogati atomski molekuli se posmatraju kao sistem povezivanja masa tačaka. Swing. ruh nuclei schodo jednaka pozicija s nenasilnom središnjom masom bez omotavanja molekule u cjelini kako bi se opisao zvuk vikoristannyam tzv. ekst. prirodno koordinate q i , koje se biraju da mijenjaju dužinu karika, valentne i diedralne ivice prostora, model molekula. Molekul, koji se sastoji od N atoma, ima n=3N - 6 (za linearni molekul 3N - 5) koraka slobode cijepanja. Prostor ima koordinate q i sklopive kolike jezgara mogu se otkriti istim kolivanima, koža sa frekvencijom pjevanja v k (k poprima vrijednosti od 1 do n), s kojom se mijenja sva priroda. koordinate q i kada su amplitude q 0 i í dodijeljene za koagulaciju faza. Takva kolivanija se naziva normalnom. Na primjer, triatomska linearna AX 2 molekula može imati tri normalne kohezije:
Kvantno-mehanički pregled takvog sistema daje diskretni niz čak i udaljenih energetskih jednakosti E(v)=hve (v+ 1/2), de v = 0, 1, 2, 3, ... - kvantni broj, v e - harmonije. kolivalna je postala molekul (h - postao Planck). Prilikom prolaska između bočnih linija, prema pravilu selekcije D v=1, foton sa energijom hv= DE=E(v+1)-E(v)=hv e (v+1+ 1/2)-hv e ( v + 1 / 2) = hv e, pa je frekvencija prijelaza između to dvoje ista, a ista je, štaviše, učestalost prijelaza između to dvoje je ista, a klasična frekvencija harmonija. kolivan. To v e se također naziva harmoničnim. frekvencija. Za stvarne molekule, krivulji potencijalne energije nije dodijeljena kvadratna funkcija q, odnosno parabola. Swing. jednaki daedali su bliže blizini intermolekularne disocijacije molekula u anharmoničnom modelu. Oscilator je opisan jednak: E(v)=, de X 1 - prvi je postao anharmoničan. Učestalost prijelaza između supstantivnih jednakih se ne prekoračuje, a, štoviše, moguće je ukrštanje, što je u skladu sa selekcijskim pravilima D v = 2, 3, .... Učestalost prijelaza iz jednakog v = 0 do jednakog v = 1 naziva se glavna ili osnovna frekvencija. Prelazak od jednakog v = 0 do jednakog v> 1 daje frekvencije prizvuka, a odlazak od jednakog v> 0 daje takozvane vruće frekvencije. U IF spektru glinenih dvoatomnih molekula, kolivalne frekvencije su uočene samo u heteronuklearnim molekulima (samo HCl, NO, CO), štoviše, pravila odabira se mijenjaju promjenom njihovih električnih. dipolni moment pri kolivacijama U Ramanovim spektrima, frekvencije kolivacije se opažaju za bilo koje dvoatomske molekule, i homonuklearne i heteronuklearne (N 2 , O 2 , CN í itd.), budući da su za takve spektre pravila selekcije određena promjenom polarizabilnosti molekula kod colivinga. Vychayutsya s KOLIVANI SPECTRUM str. harmonije. Konstantne K e i v e, konstantni anharmoničnost, kao i energija disocijacije D 0 važne su karakteristike molekula koje su neophodne za zokremu, za termohemijske ruže. Proučavanje colival-overtalnih spektra gasova i para omogućava određivanje obertalnog post-V (div. obertal spektra), momenata inercije i internuklearnih stanja dvoatomskih molekula. Bogati atomski molekuli se posmatraju kao sistem povezivanja masa tačaka. Swing. ruh nuclei schodo jednaka pozicija s nenasilnom središnjom masom bez omotavanja molekule u cjelini kako bi se opisao zvuk vikoristannyam tzv. ekst. prirodno koordinate q i , koje se biraju da mijenjaju dužinu karika, valentne i diedralne ivice prostora, model molekula. Molekul, koji se sastoji od N atoma, ima n=3N - 6 (za linearni molekul 3N - 5) koraka slobode cijepanja. Prostor ima koordinate q i sklopive kolike jezgara mogu se otkriti istim kolivanima, koža sa frekvencijom pjevanja v k (k poprima vrijednosti od 1 do n), s kojom se mijenja sva priroda. koordinate q i kada su amplitude q 0 i í dodijeljene za koagulaciju faza. Takva kolivanija se naziva normalnom. Na primjer, triatomska linearna AX 2 molekula može imati tri normalne kohezije: 
Colivanya v 1 se naziva simetrična valentna colivanny (rastezanje veza), v 2 - deformacija colivanny (promjena valentnog kuta), v 3 antisimetrična valentna colivanny. U presavijenim molekulima, oni drugi su komprimirani. normalno cijepanje (zamjena dvostranih rezova, torziona cijepanje, pulsiranje ciklusa tanko.). Kvantizacija kolivalne energije bogate atomske molekule u aproksimaciji bogate atomske harmonije. dovesti oscilator do sljedećeg, sistema kolyvalnyh rívnív energije:
de v ek - harmonije. kolivne postíyní, v k - kolívíní kvantni broj, d k - koraci virodzhennja ívnja energije na k-tom kolívíní kvantnom broju. Main frekvencije u KOLYUVAL SPEKTR str. opremljen prelazima sa nultog nivoa [sve v k = 0, kolivalna energija na nivou, koji su okarakterisani ![]()
takvi skupovi kvantnih brojeva v k , u kojima je samo jedan od njih jedan 1, a ostatak jednak 0. Yak i u slučaju dvoatomskih molekula, u anharmoničnom. Susedni mogu biti i prizvuci i „vrući“ prelazi i, štaviše, takozvana kombinacija, odnosno skladišta, prelazi za učešće jednakih, za koje su dva jednaka nuli dva ili više kvantnih brojeva v k (slika 2). 
Rice. 2. Sistem kogeneracijskih članova E/hc (cm"; c - intenzitet svjetlosti) molekula H 2 Pro i aktivni prijelaz; v 1 , v 2 . v 3 - kvantni brojevi.
Interpretacija i zastosuvannya. KOLIVANI SPEKTRI str. bogate atomske molekule odlikuju se visokom specifičnošću i predstavljaju složenu sliku, iako broj eksperimentalno zaštićenih smogova može biti dosta manji od mogućeg broja, što teoretski potvrđuje prijenos jednakih na skup jednakih. Glavne frekvencije zvuka pokazuju intenzivniji smog u VIBRACIONOM SPEKTURU sa. Pravila za izbor i promjenu prijelaza u ÍČ i KR spektra različitih, krhotina pove'yazaní vídpovídno do zmin elektrich. dipolni moment i polarizabilnost molekula u normalnoj kožnoj coli. Stoga se pojava ovog intenziteta smogova u ÍH i Ramanovom spektru na drugačiji način deponuje u tipu simetrije colivana (veličina promjene molekula, koja je posljedica koliviranja molekula). jezgri, na simetriju rada, koja karakterizira jednako važnu konfiguraciju). Deyakí zí smoog KOLINELNÍ SPECTRI p. mogu se testirati samo u HF ili u Raman spektru, ostali - sa različitim intenzitetima u oba spektra, a eksperimentalno se ne ispituju. Dakle, za molekule koji nemaju simetriju, ali mogu imati nisku simetriju bez centra inverzije, sve osnovne frekvencije se posmatraju sa različitim intenzitetom u oba spektra, za molekule sa inverzionim centrom, postoje slične frekvencije, koje se plaše da ne ponoviti u CR ogradi); Efekti frekvencija mogu biti vidljivi u oba spektra. Zato je najvažnije iz zastosuvan KOLIVALNY SPECTRUM str. - Određivanje simetrije molekula određivanjem ÍH i Ramanovog spektra, redoslijeda rangova ín. Eksperimentiraj. danich. Pitajući modele molekula različite simetrije, moguće je teoretski razviti kožne modele, koliko frekvencija u ÍCh i Ramanovom spektru može biti posterizovano i predstaviti eksperimente. dannymi robiti vídpovídny vybír modelí. Ako želite kožu normalnu colivannya, u svrhu, ê kolyvalnym žuri sve molekule, deyakí z njima, posebno u velikim molekulima, može većina zachípati manje od k.-l. fragment molekula. Amplituda pomaka jezgara, koja ne ulazi u ceo fragment, još je manja za takav normalan cep. Na čemu se široko koristi u strukturnoj analizi. koncept tzv. grupnih ili karakterističnih frekvencija: iste funkcionalne grupe ili fragmenti koji se ponavljaju u molekulima različitih polova karakterišu približno iste frekvencije u VIBRACIONOM SPEKTRU sa. (Tačno, što je uvek sa visok nivo pouzdanosti). Na primjer, karbonilnu grupu karakterizira ravnomjeran intenzivan smog u IF spektru gline u području od ~1700(b 50) cm -1, što se može vidjeti prije valentnog colivana. Trebalo bi otkriti prisustvo smoga gline u sferi spektra, ali u molekulu preostalog govora nema grupe. Upravo u tom času prisustvovalo je i dr.sc. smog u naznačenom prostoru još nije nedvosmislen dokaz prisustva u molekuli karbonilne grupe, tako da se u ovom galusu frekvencije drugih molekularnih cijepanja mogu pojaviti na drugačiji način. Stoga se vrši strukturna analiza i označavanje konformacija i frekvencija vibracija funkcija. grupe su krive za spiralu na nekoliko karakteristika. frekvencije, a peredačuvanu strukturu molekula treba potvrditi podacima u. metode (div. Strukturna hemija). Ísnuyut dovídniki, yakí místjat numeričke strukturno-spektralne korelacije; ê takođe banke podataka i napredni programi za informacione sisteme i strukturnu analizu. Doslídzhen íz vekoristannyam EOM. Tačna interpretacija KOLIVALSKOG SPEKTRA str. pomoć izotop. supstitucija atoma, što će dovesti do promjene frekvencija zvonjenja. Dakle, zamjena vode deuterijumom dovodi do promjene frekvencije X-H valentne fuzije približno 1,4 puta. Sa izotopom Zamjena molekula konstante snage K je pošteđena. Isnuê broj izotopa. pravila koja dozvoljavaju uvođenje koliving frekvencija do najmanjeg tipa koliving simetrije, funkcionalnih grupa itd. Model rozrahunki KOLIVALNI SPECTRY str. (učestalosti i intenziteti smoga) kada se daju konstante snage, poput vikorista za određenu strukturu molekula, direktno odgovaraju zahtjevima kolivalne spektroskopije. Neophodno je za ovu silnu stalnu i takozvanu elektrooptičku parametre (pojedinačne trenutne parametre, komponente tenzora polariziranosti i dr.) uzimaju u obzir srodne strukturne molekule ili podržavaju rješenja koja odgovaraju zadatku, što se navodi u određenim naborima snaga stalnih i elektrooptičkih mnogoatomnih molekula. , intenzitet i in. Eksperimentiraj. danich. Definiranje skupa osnovnih frekvencija KOLIVAL SPECTRUM str. neophodan je za proračun kolativnih doprinosa termodinamičkoj funkciji govora. Ovi podaci su potvrđeni u rozrahunka kemijskog rívnovag i za modeliranje tehnologije. procesi KOLIVANI SPEKTRI str. dozvoliti vivchati ne samo vnutrímol. dinamiku i međumolekularne interakcije. Od njih se uzimaju podaci o površinskoj potencijalnoj energiji, unutrašnjoj. Omot molekula, šačica atoma velikih amplituda. Iza KOLIVAL SPECTRA str. doslídzhuyut udruživanje molekula i strukture kompleksa različite prirode. KOLIVANI SPEKTRI str. leže u agregatnom stanju govora, što vam omogućava da uzmete informacije o strukturi različitih kondenzacija. faze. Učestalost prijelaza kolika jasno je zabilježena na pristaništu. forme sa čak i malim satom života (do 10 -11 s), na primjer, za konformere na visini potencijalne barijere u kilka kJ/mol. Tom KOLIVALNI SPEKTRI str. zastosovuyut za doslídzhennya konformacijske izomeríí̈ i shvidko vstanovlyuyutsya jednake. O vikoristannya KOLIVALNI SPECTRY str. za analizu računa i in. ciljevima, kao i o savremenoj tehnologiji kolivalne spektroskopije div. u čl. Infracrvena spektroskopija, kombinatorna spektroskopija.
Poglinannya u području od 10 2 - 10 3 cm -1 (ÍČ - regija) je okružena prstenastim prijelazima u konstantnom elektronskom stanju molekula; slični spektri se nazivaju kolivalnim. Tačnije, njihov sljedeći bi se zvao kolivalno-rotacijski, odnosno do. Promjene u kolivalnoj energiji molekula kada se gline u galusu prate, zvuče, mijenjaju i omotavaju energiju.
h \u003d E ′ - E ″ \u003d (E vr ′ + E kobilica ′) - (E wr ″ + E kobilica ″) . (2.104)
Kolivalni spektar je presavijen od niskog do udaljenog jedne vrste jednog roja, intenzitet ovih povećanja broja prehlada naglo se mijenja (slika 2.22). Persha, najintenzivnija smuga, naziva se glavna smuga ili glavni ton. Pustite da se 1. i 2. prizvuk izvuče. Intenzitet nadolazećih rojeva svjetlosti je manje izražen, pa čak ni 3. i 4. prizvuk za više molekula potomstva ne ulazi.
Kožna smuga u spektru je sklopiva i kada je snimljena na prilogu s velikim razdílnoy zdatnístyu prilad je podijeljena u niz malih linija. Pojava tako fine strukture vezana je za govor na benzinskoj stanici. Položaj smoga u rasponu karakteriziraju kolateralni prijelazi, a finu strukturu linije kože karakteriziraju izraziti prijelazi.
Da bismo razumjeli prirodu takvog spektra, pogledajmo stražnji dio glave više nego kolyvalny ruh i kolyvalny prijelaze, apstrahirajući od omotača molekula, tj.
h \u003d E kobilica - E kobilica. (2.105)
Pulsiranje dvoatomske molekule iz pogleda klasične mehanike moguće je kao periodična promjena između jezgara.

Vidpovidno prema Hookeovom zakonu, što je opisano harmonično zvonjenje, sila koja pretvara jezgre u jednake položaje proporcionalna je sili jezgara iz jednakog položaja:
f = - kq, (2.106)
de k - Snaga je brza;
q je koordinata; q \u003d r a + r b \u003d r - r e.
Hookeovo izjednačavanje vrijedi samo za male pomake jezgara, pa ako je q >> r e , između na q = 0.
Dvoatomski molekul s konstantom snage ima vrijednost koja karakterizira elastičnost veze i brojčano jače sile koje formiraju (razvlače ili stišću) vezu po jedinici dužine f = k pri q = 1.
Elementarni robot sile opruge:
dA = -fdq. (2.107)
Radi jednakosti (2.106) moramo:
dA = - kq dq. (2.108)
Nakon integracije u granice
 (2.109)
(2.109)
za potencijalnu energiju dvoatomske molekule potrebno je:
u = A = 1/2 kq2. (2.110)
Z jednako (2.110) viče to
k = (d 2 u / dq 2) q = 0. (2.111)
Na ovaj način, za male zsuvív potencijalna energija je kvadratna funkcija víd q = r - r e. Kriva u-q ili u-r je parabola, a konstanta snage k karakterizira zakrivljenost parabole blizu minimuma.
Kada se dokaže na viraz (2.110) Schrödingerovo izjednačavanje
2 kobilica + (8 2 / h 2) (E kobilica - u) kobilica \u003d 0 (2.112)
A vrh ovog nivoa je jednakiji za prirodne vrijednosti kolivalne energije dvoatomske molekule kao harmonijskog oscilatora:
E kíl \u003d h (v + 1/2) , (2.113)
de v- kvantni broj koji prihvata vrijednosti cilih pozitivnih brojeva, počevši od nule (v = 0, 1, 2, 3......);
0 - Frekvencija vibracija vibratora Vlasna.
Vlasnički kapital (2.113) može se prijaviti na drugačiji način:
E kíl \u003d hc e (v + 1/2) , (2.114)
de e je broj visoke frekvencije (kolivalna konstanta), koji karakteriše frekvenciju oscilacija, dovedenu na minimum potencijalne krive, tako da je frekvencija, po pravilu klasične mehanike, molekula mala za beskonačno malu amplitudu od oscilacije (q = 0, r = re). Vrijednost e je prikazana u m -1 ili cm -1. Vaughn je molekularno brz. Bilo da se radi o dvoatomskoj molekuli, u elektronskom stanju kože karakteriziraju ga stvarne konstantne vrijednosti e.
Jednačina (2.114) pokazuje kvantizaciju kolivalne energije i nulte energije oscilatora pri v = 0:
E 0 kíl \u003d hc e / 2. (2.115)
Tsya energija nije jednaka nuli. Energija harmonijskog oscilatora raste u direktnoj proporciji sa kvantnim brojem v, što ukazuje na sistem jednakih i udaljenih kvantnih jednakih. Vídpovídno do kvantno-mehaničkih pravila odabira za harmonijski oscilator, moguće je prijeći od v = 1. Kada je svjetlo prigušeno, mijenja se na +1, energija i amplituda kolivinga se povećavaju.
Međutim, model harmonijskog oscilatora treba podesiti na poziciju koja je odlična za eksperimentalne podatke:
1) Ekil u okviru ovog modela može biti sjajan kao i uvijek. Na ovaj način, hemijska veza u molekuli je bezgranično elastična i yogo, širenje slova bi je nemoguće. Znamo šta nije u redu;
2) za harmonijski oscilator u spektru gline samo je jedna greška strah od smuge, što je vidljivo iz pravila za izbor i ekvivalentnost prstenastih jednakosti (slika 2.23 a). Međutim, spektar prave dvoatomske molekule sumnja se na papalinu smoga.

Rice. 2.23 Krive potencijalne energije (a) i akumulacija kolatativne energije E zavojnica v_d V zavojnica (b) za harmonijski oscilator
To ne znači da su stvarni molekuli harmonijski oscilatori. Harmonična blizina s njima može se nadmašiti samo za minimalne zvukove jezgara iz tabora jednakih, tobto. pri malim vrijednostima kolivalovog kvantnog broja (v = 0; 1).
Za prave dvoatomske molekule, funkcija U(r) nije parabola, a sila koja rotira nije striktno proporcionalna pomaku jezgara. Cijena koju treba donijeti na model anharmonički oscilator, Za koji je prikazana kriva potencijalne energije, kao što je prikazano na sl. 2.24.
Za približan opis krivulje potencijalne energije, Morseova funkcija je:
u = D e 2 (2.116)
de D e - Energija disocijacije;
je konstantan za cijeli molekul.

Rice. 2.24 Krivulje potencijalne energije (a) i akumulacije kolatativne energije E kíl víd V kíl (b) za anharmonski oscilator
Uz varijaciju Schrödingerove jednadžbe za dvoatomsku molekulu, ako je u(r) izražen Morseovom funkcijom, vrijednosti kolivalne energije Ekil opisuju se binarnim terminom:
E kíl \u003d hc e (v + 1/2) - hc e x e (v + 1/2) 2, (2.117)
de x e - Koeficijent anharmoničnosti, koji karakteriše varijaciju u harmoniji, a vrednost je promenljiva, štaviše
e >> e x e > 0. (2.118)
Jednačina (2.117) se može uzeti za anharmonični oscilator nulte energije (de v = 0):
E 0 \u003d 1/2 hc e - 1/4 hc e x e. (2.119)
Z jednako (2.117) vyplyvayut vysnovki:
ugar Ekil víd v nije linearan;
kolivalní quantívní konvergirati zí zbílshennyam v.
Zaista, razlika u energiji coliving s porastom kvantnog broja za jedan mijenja se s rastom V:
E v+1 v = E (v + 1) - E (v) \u003d hc [ e - 2 e x e (v + 1)] . (2.120)
Poznajemo prije svega slične funkcije (2.117):
E v = hc e (V + 1/2) – hc e x e (V + 1/2) 2 , (2.121)
dE V /dV = hc [ e - 2 e x e (V + 1/2)] , (2.122)
d 2 E V /dV = –2hc e x e< 0 . (2.123)
Viraz da provjeri da kriva E v -V može biti maksimalna (slika 2.16, b) i kolivní rívní konvergiraju deyakogo vrijednost V max. , Šta možete znati maksimalno:
dE V / dV = 0 (2.124)
dE V /dV = hc[ e - 2 e x e (V max + 1/2)] = 0 , (2.125)
V max \u003d ( e / 2 e x e) - 1/2, (2.126)
V max = 1/2x e - 1/2
. (2.127)U ovom rangu, glavna granica diskretnih kolivnih jednaka je i maksimalnoj energiji anharmoničkog oscilatora E V, max. Kako molekuli generišu kolativnu energiju E V > EV, max, doći će do disocijacije, kao što se može vidjeti iz krive potencijalne energije (slika 2.16, a).
Rozrakhovaní za formulu (2.127) vrijednost V max za većinu molekula postaje nekoliko desetina, za deyakah - do druge stotine.
Pravila odabira:
kao za harmonijski oscilator V = 1, tada za anharmonski oscilator kvantno-mehanička pravila dozvoljavaju odabir da li je prijelaz: V = 1, 2, 3 pravedan;
može se opisati da li govor (polarni i nepolarni) ili ne.
Zamjenom vrijednosti izjednačenja V, e , x e (2.117) moguće je sabrati shemu dozvoljenih izjednačenja kogeneracije energije.
Rice. 2.25 Šema dozvoljenih plaćanja za energetski coliving.
Najveći broj dvoatomskih molekula, kolivalni prijelaz 01, iznosi 10 - 100 kJ/mol. Značajno veća od prosječne energije toplinske energije molekula plina na temperaturi od 18 - 25 pro C (RT = 2,5 kJ/mol na 298 pro K). Stoga je važno da se sa temperature veći broj molekula prebaci na niži energetski nivo, odnosno V″=0.
Pravilo odabira vam omogućava da unesete poravnanje za sve frekvencije koje su zaštićene spektrom i uđete u colival spektar:
\u003d EV / hc \u003d e (V + 1/2) - e x e (V + 1/2) 2. (2.128)
Zamjenjujući vrijednosti V i V u jednadžbu (2.128) i uzimajući razliku između brojeva, možemo uzeti:
V″ 0 \u003d [ e (V′ + 1/2) - exe (V ”+ 1/2) 2] - [ e (V ″ + 1/2) - exe (V ″ + 1 /2) 2].(2.129)
Nakon transformacije:
\u003d (V "- V ″) [ e - e x e (1 + V" + V ″)] . (2.130)
Vrahovyuchi, scho V’=0, moguće je uzeti viraz za hvilyovyh brojeva, samo je eksperimentalno pratiti niz prijelaza, indikacije za malog, i sam prijelaz V ″ (0) V ":
\u003d V "[ e - e x e (1 + V")] , (2.131)
de V" = 1, 2, 3, .... V max.
Za prijelaz 01 potrebna je najmanja energija. Tse vídpovidaê pojava u spektru gline prvog (niskofrekventnog) smoga - glavne smuge, ili glavnog tipa. Idi 02; 03 itd. za davanje uvredljivih samozadovoljstava - prizvuka.
Kvartalni brojevi glavne smuge i prizvuka su označeni na isti način do (2.131) nadolazećim rangom:
01 glavni smuga ili prizvuk,
0 1 = e - 2 e x e = e (1 - 2x e), (2.132)
02 1. ton,
0 2 = 2 e - 6 e x e = 2 e (1 - 3x e), (2.133)
03 2. ton,
0 3 = 3 e - 12 e x e = 3 e (1 - 4x e), (2.134)
Vypadku za prijelaz 0V":
0 V′ = V” e – V′(V′+1) e x e . (2.135)
Z otrimanih virazív vyplivaê, scho smugi poglanannya u kolivalnom spektru konvergiraju, želeći kroz one koji e x e<< e , эта сходимость для первых двух-трех полос выражена слабо. Величина e x e составляет обычно несколько см -1 , реже – десятки см -1 , в то время как e = 10 2 – 10 3 см -1 .
Imovirnist prelaz 01 je najveći, niži i objašnjava se intenzitet glavnog smoga gline. Pokretljivost prelaza 02; 03, itd., naglo se mijenjaju sa povećanjem V", koji se pojavljuje u spektru gline.
Oznaka colival posta e taj koeficijent anharmoničnostix e .
Najvažniji rezultat eksperimentalnog usklađivanja IF spektra polja gline je kolivalna konstanta e i koeficijent anharmoničnosti x e .
donijeti smog gline u pjevanje kolyalny prijelaze.
dodijeliti frekvenciju colivan skin prijelaza: 1 , 2 , 3 .
postavite frekvencije kože jednake tipu (2.132) - (2.135) i, kršeći ih zajedno, dodijelite e i x e . Na primjer:
0 1 = e (1–2x e)
0 2 = 2 e (1–3x e).
Označena energija disocijacije (hemijska veza). Energija hemijske veze je ona energija koju je potrebno povećati da bi se molekula prenela sa nulte na maksimalni kovalentni kvantni nivo:
Pogađanje jednako (2.127):
V max \u003d 1/2x e - 1/2.
Zamjenom vrijednosti (2.127) uzimamo:
E 0 Vmax = hc e (1/2x e - 1/2 + 1/2) - hc e x e (1/2x - 1/2 + 1/2) 2 , (2.136)
E 0 Vmax = hc e /2x e – hc e x e /4x e = hc e x e /4x, (2.137)
E max \u003d hc e / 4x e. (2.138)
Pređimo na molarne vrijednosti energije u J/mol:
E max (mol) \u003d E max N A, (2.139)
E max (mol) \u003d hc e N A / 4x e. (2.140)
Energija disocijacije, koja je energizirana na nultom nivou i unesena do 1 mol, naziva se prava energija disocijacije i označava se sa D oko:
E x.s. = D o = E max - E 0. (2.141)
Kao rezultat toga, energija disocijacije je uvučena u krivu minimalnog potencijala, ona će nadmašiti D 0 za vrijednost nulte energije (slika 2.18):
D e = D 0 + E 0. (2.142)
hc e N ALI
hc e

Pogodi šta
E 0 \u003d 1/2 hc e - 1/4 hc e x e,
D 0 \u003d hc e / 4x e - (hc e / 2 - hc e x e / 4) , (2.143)
D 0 \u003d (1-x e) 2. (2.144)
Prelazeći na molarne vrijednosti, znamo vrijednost D 0 J/mol:
D 0 \u003d (1-x e) 2. (2.145)
Ovim redom: iz colival spektra mogu se uzeti sljedeće molekularne konstante:
Vlasnu frekvenciju koliva e;
Koeficijent anharmoničnosti heh;
Energija kolivalnog kretanja molekula;
Energija hemijske veze.
Elektronski rasponi (osnovni koncepti). Kada su elektroni pobuđeni, molekuli imaju tendenciju da vibriraju u ultraljubičastim i vidljivim područjima spektra.
h \u003d E "" - E" \u003d (E "" vr - E" vr) + (E "" kobilica - E " kobilica) + (E" "jeo - E" jeo).
P  U svakom trenutku će se vidjeti slijed svih energetskih promjena. Spektar nabora se naziva elektronski-kolizioni-ukupni. Spektar je sačinjen od samozadovoljne gline. Maksimalna linija gline vídpovídaê najveći mogući prijelaz u ovoj regiji do dovzhin hvil.
U svakom trenutku će se vidjeti slijed svih energetskih promjena. Spektar nabora se naziva elektronski-kolizioni-ukupni. Spektar je sačinjen od samozadovoljne gline. Maksimalna linija gline vídpovídaê najveći mogući prijelaz u ovoj regiji do dovzhin hvil.
Slika 2.25 prikazuje ekspanziju energetskih linija MO molekularnih orbitala ( i - vezujuće MO, * i * - proširenje MO)
U glavnoj stanici, - i -orbitale su zauzete elektronima (postoji veća stabilna energetska stanica sa manje potencijalne energije).
Najveća energija koja utiče na prelaz * - pojavljuje se u dalekom UV području i utiče na molekule većine ugljenih hidrata. Prijelazi * pokazuju i vidljive i bliske UV regije i tipove za molekule nepostojećih polja.

Rice. 2.26. Krive potencijalne energije razmene tokom elektronskih prelaza 
Sa gubitkom velikih kvanta izmjenjive energije može doći do elektronskog skoka. Potencijalna energija disocijacije D0 se mijenja, a E raste. U trenutku porasta energije E dolazi do povećanja količine atomske energije r e kao rezultat kretanja rike (slika 2.26).
Za dermalni izgled, veza je sopstvena energija elektronskih prelaza i karakteriše je samozadovoljna glina sa raspevanim dožinojem dok.